题目内容
6.下列各题中有关物质的比较,请用“>”、“<”、“=”填空:(1)酸性:H3PO4<HNO3,H2SO4<HClO4;
(2)碱性:Mg(OH)2<Ca(OH)2,NaOH>Al(OH)3
(3)氧化性:F2>S,N2<O2;
(4)热稳定性:CH4< NH3,HCl>HI.
分析 (1)非金属性越强,对应最高价含氧酸的酸性越强;
(2)金属性越强,对应最高价含氧酸的碱性越强;
(3)非金属性越强,对应单质的氧化性越强;
(4)非金属性越强,对应氢化物越稳定.
解答 解:(1)非金属性越强,对应最高价含氧酸的酸性越强,则酸性:H3PO4<HNO3,H2SO4<HClO4,故答案为:<;<;
(2)金属性越强,对应最高价含氧酸的碱性越强,则碱性:Mg(OH)2<Ca(OH)2,NaOH>Al(OH)3,故答案为:<;>;
(3)非金属性越强,对应单质的氧化性越强,则氧化性:F2>S,N2<O2,故答案为:>;<;
(4)非金属性越强,对应氢化物越稳定,则热稳定性:CH4<NH3,HCl>HI,故答案为:<;>.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置和性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的综合应用,题目难度不大.

练习册系列答案
相关题目
16.以下是四种不同分子,中心原子上存在2对孤电子对的是( )
| A. |  | B. |  | C. |  | D. | H2S |
14.对于可逆反应N2+3H2?2NH3下列各项所表示的反应速率最快的是( )
| A. | ν(N2)=0.02 mol•L-1•s-1 | B. | ν(H2)=0.2 mol•L-1•s-1 | ||
| C. | ν(H2)=0.6 mol•L-1•min-1 | D. | ν(NH3)=1.2 mol•L-1•min-1 |
15.下列关于元素周期表和元素周期律的说法不正确的是( )
| A. | 元素周期表中前三周期为短周期 | |
| B. | 第IA族的元素不全是金属元素 | |
| C. | 元素性质呈现周期性变化的根本原因是元素的相对原子质量呈周期性变化 | |
| D. | 人类可以在周期表中金属与非金属的分界线处,寻找半导材料 |
16.下列说法不正确的是( )
| A. | 明矾、漂白粉、臭氧的净水原理相同 | |
| B. | “血液透析”的原理利用了胶体的性质 | |
| C. | 食品包装中常放入有硅胶和铁粉的小袋,只能防止食物受潮 | |
| D. | 煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾. |
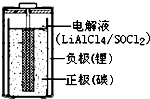 亚硫酰氯(SOCl2)是一种液态的共价化合物,沸点78.8℃,熔点-105℃
亚硫酰氯(SOCl2)是一种液态的共价化合物,沸点78.8℃,熔点-105℃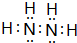
 .
.