题目内容
7.实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题:(1)请写出该实验的实验步骤:
①计算,②称量,③溶解,冷却④转移,⑤洗涤,⑥定容,摇匀、装瓶.
(2)所需仪器为:容量瓶 (规格:500mL)、托盘天平、还需要那些实验仪器才能完成该实验,请写出:烧杯、玻璃棒、胶头滴管.
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因.
①为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容.对所配溶液浓度的影响:偏大,原因是:受热膨胀时体积为0.5 L,冷却至室温时溶液体积变小.
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度.对所配溶液浓度的影响:偏小,原因是:溶液体积增大,溶液体积增大,溶质的物质的量不变.
分析 (1)根据用固体配制溶液的一般步骤为计算、称量、溶解转移、洗涤转移、定容摇匀,据此解答;
(2)根据配制一定物质的量浓度的溶液的具体操作步骤,选择所需的仪器,依据配置溶液的体积选择容量瓶的规格;
(3)分析操作对溶质的物质的量及溶液体积的影响,根据c=$\frac{n}{V}$判断误差.
解答 解:(1)用固体配制溶液的一般步骤为计算、称量、溶解、转移、洗涤、定容、摇匀、装瓶,
故答案为:计算;称量;溶解;转移;洗涤;定容;摇匀;
(2)配制1.00mol/L的NaCl溶液0.5L,应选择500mL容量瓶,称量需用药匙取氯化钠,溶解需要用烧杯,玻璃棒搅拌,转移过程中用玻璃棒引流,最后用胶头滴管定容,故还需要的玻璃仪器为:烧杯、玻璃棒、胶头滴管;
故答案为:500mL;烧杯、玻璃棒、胶头滴管;
(3)①为加速固体溶解,可稍微加热并不断搅拌,在未降至室温时,立即将溶液转移至容量瓶定容,溶液受热膨胀时体积为0.5 L,冷却至室温时体积变小,根据c=$\frac{n}{V}$可知,溶液浓度偏大;
故答案为:偏大;受热膨胀时体积为0.5 L,冷却至室温时溶液体积变小;
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,导致所溶液体积偏大,根据c=$\frac{n}{V}$可知,溶液浓度偏小;
故答案为:偏小;溶液体积增大,溶液体积增大,溶质的物质的量不变.
点评 本题考查一定物质的量浓度溶液的配制,难度不大,关键清楚溶液配制原理,注意根据c=$\frac{n}{V}$进行误差分析的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.青蒿酸(简式如图所示)可用作合成青蒿素的原料,下列关于青蒿酸的说法中正确的是( )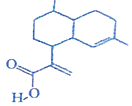

| A. | 该物质属于芳香族化合物 | B. | 该物质易溶于水 | ||
| C. | 能发生取代反应和加成反应 | D. | 分子中所有碳原子可能共平面 |
5.下列离子方程式表达正确的是( )
| A. | Na2S的水解:S2ˉ+2H2O?H2S+2OHˉ | |
| B. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| D. | 向NaClO溶液中通入少量SO2:2ClOˉ+SO2+H2O=SO32ˉ+2HClO |
2.无论在办公室还是居室里,在漂亮的花瓶中插上一束美丽的鲜花,将会给紧张而又忙碌的工作、生活带来轻松和愉悦的心情.如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命.下表是1L“鲜花保鲜剂”的成分,阅读后回答下列问题:
(1)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)2×$\frac{0.50}{174}$+$\frac{0.50}{158}$(只要求写表达式,不需计算)mol•L-1.
(2)配制过程中,下列操作配制结果没有影响的是AD(填字母).
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
| 成分 | 质量(g) | 摩尔质量(mol•L-1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
(2)配制过程中,下列操作配制结果没有影响的是AD(填字母).
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
12.下列情况将使配制溶液的物质的量浓度偏低的有( )
| A. | 容量瓶用蒸馏水洗净后,未待干燥便用来配制 | |
| B. | NaOH溶解后趁热移入容量瓶中 | |
| C. | 定容时,俯视刻度线 | |
| D. | 摇匀后发现液面未到刻度线,继续加水至刻度线 |
19. 氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
(1)已知每破坏1mol有关化学键需要的能量如表:
则△H=-91.3KJ/mol.
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将不变(填“增大”“减小”或“不变”)
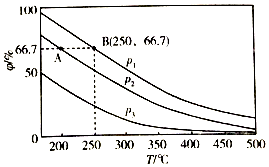
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示.
①其中,p1、p2和p3由大到小的顺序是p1>p2>p3,其原因是温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大.
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)< vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=5925.9L2/mol2(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①②③(填序号).
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
 氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.(1)已知每破坏1mol有关化学键需要的能量如表:
| H-H | N-H | N-N | N |
| 435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将不变(填“增大”“减小”或“不变”)
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示.
①其中,p1、p2和p3由大到小的顺序是p1>p2>p3,其原因是温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大.
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)< vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=5925.9L2/mol2(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①②③(填序号).
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
16. 已知五种短周期元素在周期表中的相对位置如表所示.
已知五种短周期元素在周期表中的相对位置如表所示.
(1)表中五种元素金属性最强的元素为Na(填元素符号),c、e两元素形成的离子化合物c2e的电子式为 .
.
(2)c、d、e三种元素的简单离子中,半径最小的是Al3+(用元素符号表示).
(3)b、e两元素分别与a形成的最简单气态化合物的稳定性的关系为H2O>H2S(或H2S<H2O)(用化学式表示).
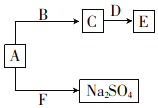
(4)已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成.它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
①写出物质E的化学式:NaAlO2.
②写出A与F反应的化学方程式:Na2O2+SO2=Na2SO4.
 已知五种短周期元素在周期表中的相对位置如表所示.
已知五种短周期元素在周期表中的相对位置如表所示.| a | |||||
| b | |||||
| c | d | e |
 .
.(2)c、d、e三种元素的简单离子中,半径最小的是Al3+(用元素符号表示).
(3)b、e两元素分别与a形成的最简单气态化合物的稳定性的关系为H2O>H2S(或H2S<H2O)(用化学式表示).
(4)已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成.它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
①写出物质E的化学式:NaAlO2.
②写出A与F反应的化学方程式:Na2O2+SO2=Na2SO4.