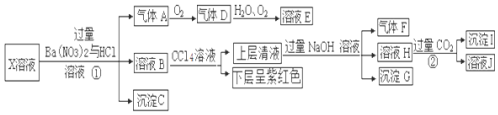
题目内容
11.分子式为C9H11Cl且含有苯环的同分异构体数目为( )| A. | 30 | B. | 36 | C. | 39 | D. | 42 |
分析 分子式为C9H11Cl且含有苯环的同分异构体,先写出苯的同系物C9H12的同分异构体,然后根据各同分异构体中含有等效H原子数目判断满足体积的有机物数目.
解答 解:含有苯环的苯的同系物C9H12的同分异构体有: ⑧
⑧
其中①分子中含有6种H原子,则其一氯代物有6种;
②分子中含有7种等效H,其一氯代物有7种;
③分子中含有7种等效H,其一氯代物有7种;
④分子中含有5种等效H,其一氯代物有5种;
⑤分子中含有6种H,其一氯代物有6种;
⑥分子中含有4种H,其一氯代物有4种;
⑦分子中含有2种H,其一氯代物有2种;
⑧分子中含有含有5种H,其一氯代物有5种;
所以满足体积的有机物结构说明为:6+7+7+5+6+4+2+5=42,
故选D.
点评 本题考查同分异构体的书写,题目难度不大,正确书写含有苯环的苯的同系物C9H12的同分异构体为解答关键,注意掌握同分异构体的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
11.关于${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、H+、${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2的说法,正确的是( )
| A. | 是氢元素的五种核素 | |
| B. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2互称为同素异形体 | |
| C. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H互称为同位素 | |
| D. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H的化学性质不同 |
2.无论在办公室还是居室里,在漂亮的花瓶中插上一束美丽的鲜花,将会给紧张而又忙碌的工作、生活带来轻松和愉悦的心情.如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命.下表是1L“鲜花保鲜剂”的成分,阅读后回答下列问题:
(1)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)2×$\frac{0.50}{174}$+$\frac{0.50}{158}$(只要求写表达式,不需计算)mol•L-1.
(2)配制过程中,下列操作配制结果没有影响的是AD(填字母).
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
| 成分 | 质量(g) | 摩尔质量(mol•L-1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
(2)配制过程中,下列操作配制结果没有影响的是AD(填字母).
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
19. 氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
(1)已知每破坏1mol有关化学键需要的能量如表:
则△H=-91.3KJ/mol.
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将不变(填“增大”“减小”或“不变”)
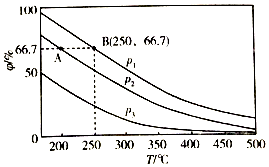
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示.
①其中,p1、p2和p3由大到小的顺序是p1>p2>p3,其原因是温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大.
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)< vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=5925.9L2/mol2(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①②③(填序号).
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
 氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.(1)已知每破坏1mol有关化学键需要的能量如表:
| H-H | N-H | N-N | N |
| 435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将不变(填“增大”“减小”或“不变”)
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示.
①其中,p1、p2和p3由大到小的顺序是p1>p2>p3,其原因是温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大.
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)< vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=5925.9L2/mol2(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①②③(填序号).
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
16. 已知五种短周期元素在周期表中的相对位置如表所示.
已知五种短周期元素在周期表中的相对位置如表所示.
(1)表中五种元素金属性最强的元素为Na(填元素符号),c、e两元素形成的离子化合物c2e的电子式为 .
.
(2)c、d、e三种元素的简单离子中,半径最小的是Al3+(用元素符号表示).
(3)b、e两元素分别与a形成的最简单气态化合物的稳定性的关系为H2O>H2S(或H2S<H2O)(用化学式表示).
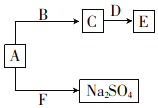
(4)已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成.它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
①写出物质E的化学式:NaAlO2.
②写出A与F反应的化学方程式:Na2O2+SO2=Na2SO4.
 已知五种短周期元素在周期表中的相对位置如表所示.
已知五种短周期元素在周期表中的相对位置如表所示.| a | |||||
| b | |||||
| c | d | e |
 .
.(2)c、d、e三种元素的简单离子中,半径最小的是Al3+(用元素符号表示).
(3)b、e两元素分别与a形成的最简单气态化合物的稳定性的关系为H2O>H2S(或H2S<H2O)(用化学式表示).
(4)已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成.它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
①写出物质E的化学式:NaAlO2.
②写出A与F反应的化学方程式:Na2O2+SO2=Na2SO4.
20.为了高效解决化石燃料燃烧存在的问题,不需要研究的问题有( )
| A. | 杜绝化石燃料的使用,从源头上解决问题 | |
| B. | 减少燃料燃烧产生的热量损耗的技术,提高燃料利用率的措施 | |
| C. | 防止燃料燃烧造成环境污染的方法 | |
| D. | 通过化学方法把化石燃料转化成洁净燃料 |
1.资料显示:O2的氧化性随溶液pH的增大逐渐减弱.室温下,某学习小组利用下图装置探究不同条件下KI与O2的反应,实验记录如下.
回答下列问题:
(1)实验③的目的是验证Cl-是否影响KI与O2的反应.
(2)实验②中发生反应的离子方程式是4I-+O2+4H+=2I2+2H2O.
(3)实验②比实验④溶液颜色深的原因是其他条件相同时,HCl是强电解质,溶液中c(H+)较醋酸大,O2的氧化性较强.
为进一步探究KI与O2的反应,用上述装置继续进行实验:
对于实验⑥的现象.甲同学猜想“pH=10时O2不能氧化I-”,他设计了下列装置进行实验以验证猜想.
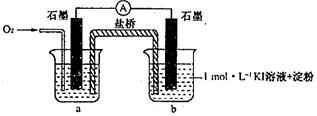
(4)烧杯a中的溶液为pH=10的KOH溶液.
(5)实验结果表明此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b中的溶液逐渐变蓝色.
(6)乙同学向pH=10的“KOH一淀粉溶液”中滴加碘水,溶液先变蓝后迅速褪色,经检测褪色后的溶液中含有IO3-,用离子方程式表示退色的原因是3I2+6OH-=IO3-+5I-+3H2O.
(7)该小组同学对实验过程进行了整体反思,推测实验①和实验⑥的现象产生的原因分别可能是中性条件下,O2的氧化性比较弱,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
| 序号 | 烧杯中的液体 | 5分钟后现象 |
| ① | 2mL 1mol•L-1KI溶液+5滴淀粉 | 无明显变化 |
| ② | 2mL1mol•L-1KI 溶液+5 滴淀粉+2mL0.2mol•L-1HC1 | 溶液变蓝 |
| ③ | 2mLl mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1KC1 | 无明显变化 |
| ④ | 2mL1mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1CH3COOH | 溶液变蓝,颜色 较②浅 |
(1)实验③的目的是验证Cl-是否影响KI与O2的反应.
(2)实验②中发生反应的离子方程式是4I-+O2+4H+=2I2+2H2O.
(3)实验②比实验④溶液颜色深的原因是其他条件相同时,HCl是强电解质,溶液中c(H+)较醋酸大,O2的氧化性较强.
为进一步探究KI与O2的反应,用上述装置继续进行实验:
| 序号 | 烧杯中的液体 | 5小时后现象 |
| ⑤ | 2mL混有KOH的pH=8.5的lmol•L-1KI溶液+5滴淀粉 | 溶液略变蓝 |
| ⑥ | 2mL混有KOH的pH=10的lmol•L-1KI溶液+5滴淀粉 | 无明显变化 |

(4)烧杯a中的溶液为pH=10的KOH溶液.
(5)实验结果表明此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b中的溶液逐渐变蓝色.
(6)乙同学向pH=10的“KOH一淀粉溶液”中滴加碘水,溶液先变蓝后迅速褪色,经检测褪色后的溶液中含有IO3-,用离子方程式表示退色的原因是3I2+6OH-=IO3-+5I-+3H2O.
(7)该小组同学对实验过程进行了整体反思,推测实验①和实验⑥的现象产生的原因分别可能是中性条件下,O2的氧化性比较弱,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.