题目内容
4.研究含氮污染物的治理是环保的一项重要工作.合理应用和处理氮的化合物,在生产生活中有重要意义.(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5 kJ•mol-1,利于
该反应自发进行的条件是低温(选填“高温”或“低温”).
(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),反应过程中 部分物质的浓度变化如图1所示:
①反应从开始到9min时,用CO2表示该反应的速率是0.0044mol/(L•min)(保留2位有效数字)
②第12min时改变的条件是升温(填“升温或降温”).
③第18min时建立新的平衡,此温度下的平衡常数为$\frac{0.0{2}^{2}×0.01}{0.1{8}^{2}×0.0{8}^{2}}$(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将逆向移动(填“正向”、“逆向”或“不”).
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图如图2正确且能说明反应在t1时刻达到平衡状态的是BD(填序号).

(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(4)以氨为燃料可以设计制造氨燃料电池,产物无污染.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
分析 (1)依据热化学方程式和盖斯定律计算所需热化学方程式;当△G=△H-T•△S<0时,反应能自发进行;
(2)①图象分析可知一氧化碳浓度变化为0.04mol/L,二氧化碳生成浓度为0.04mol/L,反应速率v=$\frac{△c}{△t}$计算;
②图象分析判断12min后反应物浓度增大,生成物浓度减小,说明平衡逆向进行,反应是放热反应,升温改变符合图象变化;
③依据图象读出平衡浓度,结合平衡常数概念计算平衡常数,再加入物质浓度,可以利用浓度商计算和平衡常数比较判断反应进行的方向;
(3)A、到达平衡后正、逆速率相等,不再变化;
B、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
D、到达平衡后各组分的含量不发生变化;
(4)碱性燃料电池中,负极上燃烧失电子发生氧化反应.
解答 解:(1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
根据盖斯定律③×2-②-①可知:则汽车尾气处理的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=(-393.5kJ•mol-1)-(-221.0kJ•mol-1)-(180.5kJ•mol-1)=-746.5KJ/mol,2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0,正反应气体体积减小,△S<0,反应能自发进行,应满足△H-T•△S<0,需低温下进行,
故答案为:-746.5KJ/mol;低温;
(2)①反应从开始到9min时,图象分析可知一氧化碳浓度变化为0.04mol/L,二氧化碳生成浓度为0.04mol/L,用CO2表示该反应的速率=$\frac{0.04}{9}$mol/(L•min)≈0.0044mol/(L•min),
故答案为:0.0044mol/(L•min);
②图象分析可知12min后一氧化氮和一氧化碳浓度增大,氮气浓度减小,说明平衡逆向进行,反应是放热反应,升温平衡逆向进行,符合图象变化,
故答案为:升温;
③依据图象分析,18min时平衡状态下物质的浓度为c(NO)=0.18mol/L,c(CO)=0.08mol/L,c(N2)=0.01mol/L,c(CO2)=0.02mol/L,反应的平衡常数依据平衡常数概念计算,2NO(g)+2CO(g)?N2(g)+2CO2(g),K=$\frac{C(C{O}_{2})C({N}_{2})}{{C}^{2}(NO){C}^{2}(CO)}$=$\frac{0.0{2}^{2}×0.01}{0.1{8}^{2}×0.0{8}^{2}}$;若保持温度不变,此时再向容器中充入CO、NO各0.060mol,浓度商计算Qc=$\frac{0.0{2}^{2}×0.07}{0.1{8}^{2}×0.1{4}^{2}}$=0.044>K,平衡逆向进行,
故答案为:$\frac{0.0{2}^{2}×0.01}{0.1{8}^{2}×0.0{8}^{2}}$;逆向;
(3)A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故B正确;
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确,
故答案为:BD;
(4)碱性燃料电池中,负极上燃烧失电子发生氧化反应,所以该原电池中负极上氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查了盖斯定律求焓变、化学平衡影响因素,化学反应速率,平衡常数概念计算应用、原电池等知识,注意平衡的条件分析是解题关键,题目难度中等.

| A. | Na2S的水解:S2ˉ+2H2O?H2S+2OHˉ | |
| B. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| D. | 向NaClO溶液中通入少量SO2:2ClOˉ+SO2+H2O=SO32ˉ+2HClO |
| A. | 容量瓶用蒸馏水洗净后,未待干燥便用来配制 | |
| B. | NaOH溶解后趁热移入容量瓶中 | |
| C. | 定容时,俯视刻度线 | |
| D. | 摇匀后发现液面未到刻度线,继续加水至刻度线 |
 氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.(1)已知每破坏1mol有关化学键需要的能量如表:
| H-H | N-H | N-N | N |
| 435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将不变(填“增大”“减小”或“不变”)
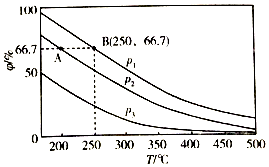
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示.
①其中,p1、p2和p3由大到小的顺序是p1>p2>p3,其原因是温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大.
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)< vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=5925.9L2/mol2(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①②③(填序号).
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
| 序号 | 反应温度/℃ | C(H2O2)/mol-L | V(H2O2)/mL | M(MnO2)/g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4作对比(填序号).
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
 已知五种短周期元素在周期表中的相对位置如表所示.
已知五种短周期元素在周期表中的相对位置如表所示.| a | |||||
| b | |||||
| c | d | e |
 .
.(2)c、d、e三种元素的简单离子中,半径最小的是Al3+(用元素符号表示).
(3)b、e两元素分别与a形成的最简单气态化合物的稳定性的关系为H2O>H2S(或H2S<H2O)(用化学式表示).
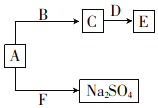
(4)已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成.它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
①写出物质E的化学式:NaAlO2.
②写出A与F反应的化学方程式:Na2O2+SO2=Na2SO4.
| A. | 质子数:a>b | B. | 离子半径:r(aX+)>r(bY-) | ||
| C. | X、Y可形成XY2型化合物 | D. | 原子半径:r(Y)>r(X) |

 $→_{②H+/H_{2}O}^{①HCN}$
$→_{②H+/H_{2}O}^{①HCN}$ (R'可以是烃基,也可以是H原子)
(R'可以是烃基,也可以是H原子) ,2分子E在浓硫酸、加热的条件下可以生成一种含六元环的化合物,该化合物的结构简式为
,2分子E在浓硫酸、加热的条件下可以生成一种含六元环的化合物,该化合物的结构简式为 .
. )的合成路线(无机试剂可以任选)
)的合成路线(无机试剂可以任选)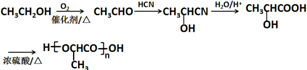 .
.

 .
.