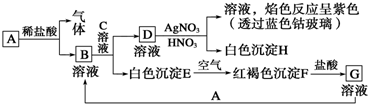
题目内容
4.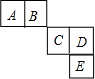 前四周期主族元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中C元素原子的最外层电子数与最内层电子敦之和等于其电子总数的一半,下列说法正确的是( )
前四周期主族元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中C元素原子的最外层电子数与最内层电子敦之和等于其电子总数的一半,下列说法正确的是( )| A. | 元素A、B的所有氢化物中均只含有极性共价键 | |
| B. | 元素C、D形成的简单离子的电子总数不同 | |
| C. | 元素C、D、E形成的常见单质的熔沸点大小:E>D>C | |
| D. | C、D、E三种元素最高价氧化物对应的水化物中D的酸性最强 |
分析 前四周期主族元素A、B、C、D、E在元素周期表中的相对位置如图所示,则E位于第四周期、CD处于第三周期,C元素原子的最外层电子数与最内层电子数之和等于其电子总数的一半,设C的最外层电子式为x,则x+2=$\frac{1}{2}$(2+8+x),解得x=6,则C为S元素、D为Cl元素、E为Br元素、A为C元素、B为N元素,据此进行解答.
解答 解:前四周期主族元素A、B、C、D、E在元素周期表中的相对位置如图所示,则E位于第四周期、CD处于第三周期,C元素原子的最外层电子数与最内层电子数之和等于其电子总数的一半,设C的最外层电子式为x,则x+2=$\frac{1}{2}$(2+8+x),解得x=6,则C为S元素、D为Cl元素、E为Br元素、A为C元素、B为N元素,
A.A为C元素、B为N元素,烃类属于C的氢化物,多个C原子的烃类物质中含有C-C非极性键,故A错误;
B.C为S元素、D为Cl元素,二儿子的简单离子为硫离子和氯离子,二者都含有18个电子,故B错误;
C.C为S元素、D为Cl元素、E为Br元素,对应单质为硫单质、氯气和溴,常温下硫单质为固态、氯气为气态、溴为液态,则熔沸点大小为:S>Br2>Cl2,即:C>E>D,故C错误;
D.C为S元素、D为Cl元素、E为Br元素,非金属性最强的为Cl元素,则三种元素最高价氧化物对应的水化物中D的酸性最强,故D正确;
故选D.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,正确推断C元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
12.下列原子序数表示的原子间能以共价键相互结合成稳定化合物的是( )
| A. | 10与19 | B. | 6与14 | C. | 11与17 | D. | 12与8 |
19.某海水浓缩液中含有大量的Na、Cl、Br、I(其他离子可以忽略不计),还原性:I->Br->Cl-.取1L该浓缩液,向其中通入一定量的Cl2,溶液中三种阴离子的物质的量与通人Cl2的体积(标准状况)的关系如表,下列有关说法中不正确的是( )
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
| A. | 当通入Cl2的体积为2.8L时,只有I-与Cl2发生反应 | |
| B. | 当通入Cl2的体积为2.8-5.6L时,只有Br-与Cl2发生反应 | |
| C. | a=0.15 | |
| D. | 原溶液中c(Cl-):c(Br-):c(I-)=10:15:4 |
9.设NA为阿伏伽德罗常数,下列说法中正确的是( )
| A. | 5.6g Fe粉与足量的稀硝酸完全反应,失电子总数为0.2NA | |
| B. | 2NA个二氧化碳分子的质量为44g | |
| C. | 1000mL0.1mol/L的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 17g氨气中所含原子数为NA |
16.将H2S、SO2、SO3各0.01mol,依次溶于1L水中,则最后得到的溶液有( )
| A. | 中性、漂白性 | B. | 酸性、漂白性 | C. | 只有酸性 | D. | 只有漂白性 |
11.应用元素周期律对深化物质性质的认识具有重要的作用,有利于将零乱的元素化合物知识整合起来形成知识网络.分析下列推断,其中不正确的是( )
| A. | 碱金属单质的熔点随原子序数的增大而降低 | |
| B. | Cs是第ⅠA族元素,Cs失电子能力比Na的强 | |
| C. | 砹(At)是第VIIA族,其氢化物的稳定性大于HCl | |
| D. | 第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱 |
12.工业上制备纯净的氯化锌时,将含杂质的氯化锌溶于过量盐酸中,为了除去杂质需调节溶液的pH到4,应加入的试剂是( )
| A. | NaOH | B. | NH3•H2O | C. | ZnO | D. | ZnCl2 |