题目内容
11.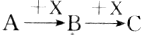 已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )
已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )| A. | SiO2 | B. | CH3CH2OH | C. | AlCl3 | D. | Cl2 |
分析 能够与二氧化硅反应的物质为碳单质、氢氧化钠溶液、HF、碳酸钙等,这些物质都不能满足题干转化关系,而乙醇利用连续被氧气催化氧化、氯化铝溶液能够与氢氧化钠溶液连续反应、氯气与溴化亚铁的反应也可以满足题干转化关系,据此进行解答.
解答 解:A.SiO2为难溶酸性氧化物,可以与NaOH溶液、碳单质、HF、碳酸钙等物质反应,但是二氧化硅无法满足题干转化关系,故A正确;
B.若A为乙醇,X为氧气,乙醇催化氧化生成B乙醛,乙醛催化氧化生成C乙酸,且乙醇与乙酸能够发生酯化反应,满足该转化关系,A可以为乙醇,故B错误;
C.氯化铝与少量氢氧化钠溶液反应生成氢氧化铝沉淀,氢氧化铝能够与氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠能够与氯化铝发生双水解反应生成氢氧化铝沉淀,所以A可以为AlCl3,故C错误;
D.X为FeBr2时,A为氯气,氯气与少量的FeBr2反应生成氯化铁和溴单质,溴单质还能够与反应生成溴化铁,且溴化铁能够与氯气反应,满足条件,故D错误;
故选A.
点评 本题考查了常见元素单质及其化合物性质,题目难度中等,明确题干转化关系及限制条件的含义为解答关键,注意熟练掌握常见元素单质及其化合物性质,试题培养了学生的逻辑推理能力.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
1.实验室需要配置去100ml 1.0×10-2mol/L的CuSO4溶液,下列玻璃仪器中,一定不要用到的是( )
| A. | 漏斗 | B. | 玻璃棒 | C. | 烧杯 | D. | 容量瓶 |
19.某海水浓缩液中含有大量的Na、Cl、Br、I(其他离子可以忽略不计),还原性:I->Br->Cl-.取1L该浓缩液,向其中通入一定量的Cl2,溶液中三种阴离子的物质的量与通人Cl2的体积(标准状况)的关系如表,下列有关说法中不正确的是( )
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
| A. | 当通入Cl2的体积为2.8L时,只有I-与Cl2发生反应 | |
| B. | 当通入Cl2的体积为2.8-5.6L时,只有Br-与Cl2发生反应 | |
| C. | a=0.15 | |
| D. | 原溶液中c(Cl-):c(Br-):c(I-)=10:15:4 |
16.将H2S、SO2、SO3各0.01mol,依次溶于1L水中,则最后得到的溶液有( )
| A. | 中性、漂白性 | B. | 酸性、漂白性 | C. | 只有酸性 | D. | 只有漂白性 |
1.一定条件下,H2O2在水溶液中发生分解反应:2H2O2$\frac{\underline{\;一定条件\;}}{\;}$2H2O+O2↑.反应过程中,测得不同时间H2O2的物质的量浓度如下表所示:
(1)在H2O2分解反应中,氧化产物和还原产物的质量之比是8:9.
(2)在0-20min时间内,该反应的平均反应速率v(H2O2)=0.02mol/(L•min).
(3)若反应所用的H2O2溶液为100mL(忽略溶液体积的变化),则80min时,反应共产生O21.44g.
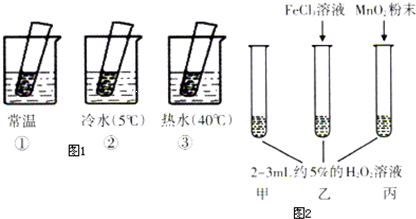
(4)如图1、图2是某学生探究外界条件对H2O2分解反应速率的影响实验装置示意图,请按表格要求填写空白.
实验一:(试管中均为滴有FeCl3溶液的5%H2O2溶液)
实验二:
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 1.0 | 0.60 | 0.40 | 0.20 | 0.10 |
(2)在0-20min时间内,该反应的平均反应速率v(H2O2)=0.02mol/(L•min).
(3)若反应所用的H2O2溶液为100mL(忽略溶液体积的变化),则80min时,反应共产生O21.44g.
(4)如图1、图2是某学生探究外界条件对H2O2分解反应速率的影响实验装置示意图,请按表格要求填写空白.
实验一:(试管中均为滴有FeCl3溶液的5%H2O2溶液)
| 现象 | 结论 | |
| 热水中 | 溶液中有气泡产生,比常温快 | 升高温度,H2O2的分解速率加快 |
| 常温中 | 溶液中有气泡产生,且速度较快 | 无 |
| 冷水中 | 溶液中有气泡产生,比常温慢 | 降低温度,H2O2的分解速率减慢 |
| 现象 | 结论 | |
| 丙加入MnO2 | MnO2能加快化学反应速率 | |
| 乙加入FeCl3 | FeCl3能加快化学反应速率 | |
| 甲不加其他试剂 | 溶液中有少量气泡出现 | 不使用催化剂化学反应速率较小 |

18.X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
请回答下列问题:
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是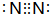 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
| X | Y | |
| Z | W |
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是
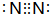 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
 .
. ,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.