题目内容
铁丝在氯气中点燃发生反应:2Fe+3Cl2
2FeCl3,其中氯元素的化合价 (填“升高”或“降低”),氯元素被 (填“氧化”或“还原”);Fe做 剂,具有 性.在该反应中,若消耗了1mol Fe,则生成 mol FeCl3,转移 mol电子.
| ||
考点:氧化还原反应
专题:氧化还原反应专题
分析:在氧化还原反应中,元素的化合价降低,得到电子被还原,含元素化合价降低的物质为氧化剂,具有氧化性,元素的化合价升高的为还原剂,具有还原性,由铁原子守恒来分析生成的FeCl3,根据化合价的变化计算转移的电子数.
解答:
解:在反应2Fe+3Cl2
2FeCl3中,Cl元素的化合价由0降低为-1价,作氧化剂,具有氧化性,在反应中被还原,Fe元素的化合价升高作还原剂,具有还原性;
由反应方程式及铁原子守恒可知,消耗了1molFe,则生成1molFeCl3,
Fe从0价升高到+3价,转移3个电子,则1molFe转移3mol电子;
故答案为:降低;还原;还原;还原性;1;3.
| ||
由反应方程式及铁原子守恒可知,消耗了1molFe,则生成1molFeCl3,
Fe从0价升高到+3价,转移3个电子,则1molFe转移3mol电子;
故答案为:降低;还原;还原;还原性;1;3.
点评:本题考查氧化还原反应,明确反应的实质及氧化还原反应中的基本概念是解答的关键,难度不大.

练习册系列答案
相关题目
在密闭容器中,反应2X(g)+Y2(g)?2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是( )
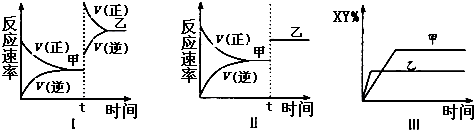

| A、图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2 |
| B、图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低 |
| C、图Ⅱ中,t时间是增大了压强 |
| D、图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲 |
在以离子键为主的化学键中常含有共价键的成分,下列各对原子形成化学键中共价键成分最少的是( )
| A、Cl,F | B、Na,F |
| C、Na,Cl | D、Mg,O |
在下列化学方程式中,能够用离子方程式H++OH-=H2O表示的是( )
| A、醋酸溶液与氢氧化钠溶液反应 |
| B、盐酸与氨水反应 |
| C、硫酸氢钠溶液与氢氧化钾溶液反应 |
| D、氢氧化铁与硫酸溶液反应 |
下列关于能量转换的认识中,不正确的是( )
| A、电解水生成氢气和氧气时,电能转化为化学能 |
| B、绿色植物进行光合作用时,太阳能转化为化学能 |
| C、每个化学反应都伴随着能量的变化 |
| D、当反应物浓度等于生成物浓度时,可逆反应一定已达到化学平衡状态 |
胶体区别于其他分散系的本质特征是( )
| A、胶体带电,有电泳的性质 |
| B、不能透过半透膜 |
| C、分散质粒子直径在1nm~100nm之间 |
| D、布朗运动 |
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、常温常压下,23g的NO2含有的氧原子数为NA |
| B、已知某种元素的一种原子的质量为ag,则该元素的相对原子质量近似为aNA |
| C、某密闭容器盛有0.1molN2和0.4molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
| D、80gNH4NO3晶体中含有NH4+小于NA个 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、22.4 L O2中含有氧分子的个数为2NA |
| B、24g Mg与足量氧气反应转移的电子数为2NA |
| C、28g N2中含有氮原子的个数为NA |
| D、1L 1 mol?L-1MgCl2溶液中含有氯离子个数为NA |