题目内容
在密闭容器中,反应2X(g)+Y2(g)?2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是( )
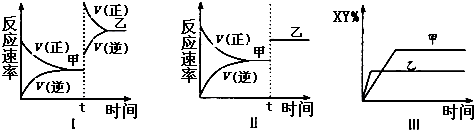

| A、图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2 |
| B、图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低 |
| C、图Ⅱ中,t时间是增大了压强 |
| D、图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲 |
考点:化学反应速率与化学平衡图象的综合应用
专题:
分析:该可逆反应是反应前后气体体积减小的放热反应,
A.图I中,改变条件,平衡向正反应方向移动,改变条件时反应速率与原来平衡点没有接触点,说明改变的条件是增大压强,平衡常数只与温度有关,温度不变,化学平衡常数不变;
B.该反应前后气体体积计量数之和改变,图II中,改变条件平衡不移动,说明加入的是催化剂;
C.该反应前后气体体积计量数之和改变,图II中,改变条件平衡不移动,说明加入的是催化剂;
D.如果改变的条件是温度,根据“先拐先平数值大”知,则乙温度高于甲.
A.图I中,改变条件,平衡向正反应方向移动,改变条件时反应速率与原来平衡点没有接触点,说明改变的条件是增大压强,平衡常数只与温度有关,温度不变,化学平衡常数不变;
B.该反应前后气体体积计量数之和改变,图II中,改变条件平衡不移动,说明加入的是催化剂;
C.该反应前后气体体积计量数之和改变,图II中,改变条件平衡不移动,说明加入的是催化剂;
D.如果改变的条件是温度,根据“先拐先平数值大”知,则乙温度高于甲.
解答:
解:该可逆反应是反应前后气体体积减小的放热反应,
A.图I中,改变条件,平衡向正反应方向移动,改变条件时反应速率与原来平衡点没有接触点,说明改变的条件是增大压强,平衡常数只与温度有关,温度不变,化学平衡常数不变,所以K1=K2,故A错误;
B.该反应前后气体体积计量数之和改变,图II中,改变条件正逆反应速率相等,平衡不移动,说明加入的是催化剂,故B错误;
C.根据B知,改变的条件是催化剂,故C错误;
D.该反应的正反应是放热反应,升高温度平衡向逆反应方向移动,则产物含量减少,如果改变的条件是温度,根据“先拐先平数值大”知,则乙温度高于甲,故D正确;
故选D.
A.图I中,改变条件,平衡向正反应方向移动,改变条件时反应速率与原来平衡点没有接触点,说明改变的条件是增大压强,平衡常数只与温度有关,温度不变,化学平衡常数不变,所以K1=K2,故A错误;
B.该反应前后气体体积计量数之和改变,图II中,改变条件正逆反应速率相等,平衡不移动,说明加入的是催化剂,故B错误;
C.根据B知,改变的条件是催化剂,故C错误;
D.该反应的正反应是放热反应,升高温度平衡向逆反应方向移动,则产物含量减少,如果改变的条件是温度,根据“先拐先平数值大”知,则乙温度高于甲,故D正确;
故选D.
点评:本题考查图象分析,侧重考查学生分析问题能力,根据图象中纵横坐标的含义再结合方程式特点分析解答,注意结合“先拐先平数值大”、“定一议二”方法分析图象题,题目难度中等.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
下列物质中,不能用做抗酸药的是( )
| A、氢氧化铝 | B、碳酸钡 |
| C、碳酸氢钠 | D、碳酸镁 |
下列叙述中,不正确的是( )
| A、氯水中的次氯酸具有杀菌消毒作用 |
| B、陶瓷的主要成分是碳酸钙 |
| C、硅是制造太阳能电池的常用材料 |
| D、漂白粉的有效成分是次氯酸钙 |
下列说法正确的是( )
| A、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| B、用PH试纸测得氯水的PH约为3 |
| C、纯净的H2在Cl2中安静的燃烧,发出苍白色的火焰,集气瓶口有白烟生成 |
| D、氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
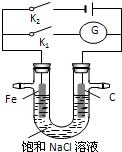

| A、K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B、K1闭合,石墨棒周围溶液pH逐渐升高 |
| C、K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D、K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |
下列离子方程式书写正确的是( )
| A、CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓ |
| B、澄清石灰水与稀盐酸反应:OH-+H+=H2O |
| C、NaHSO3溶液与NaHSO4溶液混合:SO32-+2H+=H2O+SO2↑ |
| D、铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu |