题目内容
4.下列实验设计或操作合理的是abcf.a.用分液漏斗可以将溴苯和水的混合物分离,用NaOH溶液可以除去溴苯中溶有的Br2
b.只用水就能鉴别苯、硝基苯、乙醇
c.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度
d.用浓硫酸、浓硝酸、苯于50-60℃制取硝基苯时必须将温度计的水银球插入反应液中,测定反应液的温度
e.将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子.
f.可以用四氯化碳萃取碘水中的碘单质.
分析 a.溴苯和水分层,NaOH与溴反应后与溴苯分层;
b.苯与水分层在上层、硝基苯与水分层在下层、乙醇与水互溶;
c.乙醇与浓硫酸加热至170℃发生消去反应生成乙烯;
d.制备硝基苯,水浴加热;
e.水解后检验溴离子,应在酸性条件下;
f.碘不易溶于水,易溶于四氯化碳.
解答 解:a.溴苯和水分层,NaOH与溴反应后与溴苯分层,选分液漏斗可分离,故正确;
b.苯与水分层在上层、硝基苯与水分层在下层、乙醇与水互溶,现象不同,可鉴别,故正确;
c.乙醇与浓硫酸加热至170℃发生消去反应生成乙烯,则温度计的水银球插入反应液中,测定反应液的温度,故正确;
d.制备硝基苯,水浴加热,则温度计的水银球在烧杯中,测定水温度,故错误;
e.水解后检验溴离子,应在酸性条件下,没有加碱至碱性,不能检验,故错误;
f.碘不易溶于水,易溶于四氯化碳,则用四氯化碳萃取碘水中的碘单质,故正确;
故答案为:abcf.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、混合物分离提纯、有机物的制备、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
14.下列温室气体中,和 CO2一样,既是非极性分子,所有的原子又都达到8电子稳定结构的是( )
| A. | N2O | B. | CF2=CF2 | C. | CCl2F2 | D. | SF6 |
15.氯的含氧酸根离子有ClO-、ClO2-、ClO3-、ClO4-等,有关它们的下列说法正确的是( )
| A. | ClO-中氯元素显+1价,具有很强的还原性 | |
| B. | 这些离子结合H+的能力,ClO4-最强 | |
| C. | ClO3-是NO3-的等电子体,其空间构型为平面三角形 | |
| D. | ClO2-、ClO3-、ClO4-中的氯原子都采取sp3杂化,离子中相邻两个Cl-O键间键角依次增大 |
12.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为2:1的有( )
| A. | CH3COOCH3 | B. | CH3COCH3 | C. | C6H5OH | D. | CH2=CH-CH=CH2 |
19.下列电子式书写错误的是( )
| A. |  | B. |  | C. |  | D. |  |
9.下列有关氢化物的叙述中正确的是( )
| A. | 在卤化氢中HF最稳定 | B. | HCl的电子式为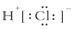 | ||
| C. | 一个D2O分子所含的中子数为8 | D. | 稳定性:H2S>HF |
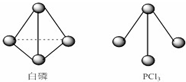
3.白磷分子(P4)为正四面体构型,其中P原子的杂化形式为( )
| A. | sp3 | B. | sp2 | C. | sp | D. | 不确定 |
 ①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6KJ/mol.
①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6KJ/mol.