题目内容
11.工业制玻璃主要原料有石英、纯碱和石灰石.在玻璃窑中发生主要反应的化学方程式为:①Na2CO3+SiO2$\stackrel{高温}{→}$Na2SiO3+CO2↑;
②CaCO3+SiO2$\stackrel{高温}{→}$CaSiO3+CO2↑
(1)反应①中,被破坏的微粒间的作用力有bc(选填编号).
a.范德华力 b.离子键 c.共价键
(2)上述两个反应的反应物和生成物中,涉及到的不同类型的晶体有3种(填数字),其中熔沸点最低的化合物的电子式为
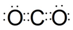 ;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.
;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.(3)纯碱中的金属阳离子的半径比铝离子半径大(填“大”或“小”);石灰石中的金属阳离子的电子所占据的电子层中,能量最高的是M层(填“电子层符号”).
(4)已知10g碳酸钙完全分解,共吸收17.56KJ的热量,写出该反应的热化学方程式:CaCO3(s)=CaO(s)+CO2(g)△H=+175.6 KJ/mol.
分析 (1)根据化合物中存在的化学键分析;
(2)含有离子键的化合物属于离子晶体,分子之间通过分子间作用力结合的属于分子晶体,原子间通过共价键结合形成空间网状结构的晶体为原子晶体;分子晶体的熔点小于原子晶体和离子晶体;分子晶体的相对分子质量越大,范德华力大,熔沸点越高;
(3)同周期从左到右阳离子半径逐渐减小;石灰石中阳离子为钙离子,其离子核外有三个电子层;
(4)10g碳酸钙完全分解,共吸收17.56KJ的热量,则1mol碳酸钙分解吸收175.6 KJ热量.
解答 解:(1)Na2CO3+SiO2$\stackrel{高温}{→}$Na2SiO3+CO2↑;反应中,被破坏的微粒间的作用力有离子键和共价键;
故答案为:bc;
(2)①Na2CO3+SiO2$\stackrel{高温}{→}$Na2SiO3+CO2↑; ②CaCO3+SiO2$\stackrel{高温}{→}$CaSiO3+CO2↑;两个反应中碳酸钠、碳酸钙、硅酸钠以及硅酸钙属于离子晶体,二氧化碳属于分子晶体;二氧化硅属于原子晶体;分子晶体的熔点小于原子晶体和离子晶体,所以二氧化碳熔沸点最低,二氧化碳的电子式为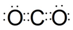 ;分子晶体的相对分子质量越大,范德华力大,熔沸点越高,CO2和CS2都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,所以CO2熔沸点低于CS2;
;分子晶体的相对分子质量越大,范德华力大,熔沸点越高,CO2和CS2都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,所以CO2熔沸点低于CS2;
故答案为:3;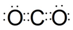 ;两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2;
;两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2;
(3)同周期从左到右阳离子半径逐渐减小,则钠离子的半径大于铝离子;石灰石中阳离子为钙离子,其离子核外有三个电子层,最外层为M层,即能量最高的是M;
故答案为:大;M;
(4)10g碳酸钙的物质的量为0.1mol,完全分解,共吸收17.56KJ的热量,则1mol碳酸钙分解吸收175.6 KJ热量,其热化学方程式为:CaCO3(s)=CaO(s)+CO2(g)△H=+175.6 KJ/mol;
故答案为:CaCO3(s)=CaO(s)+CO2(g)△H=+175.6 KJ/mol.
点评 本题以硅酸盐的有关反应为知识背景,考查化学键、电子式、离子半径比较、熔沸点比较、热化学方程式等知识,注意元素周期律的应用,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | FeO | B. | Fe2O3 | C. | CuO | D. | Cu2O |
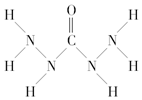
| A. | A中氧元素非金属性最强,故只有氧元素显负价 | |
| B. | 由A中的四种元素组成的化合物可能是离子化合物 | |
| C. | A分子中存在两类共价键 | |
| D. | A分子中氮原子没有孤电子对而氧原子有 |
| A. | Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应 | |
| B. | NaHCO3固体中混有的Na2CO3可用加热的方法除去 | |
| C. | Na2O2和Na2O中阴阳离子个数比均为1:2 | |
| D. | 分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同 |
| A. | K+、Na+、NO3-、MnO4- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | K+、Cu2+、Br-、S2- | D. | NH4+、Al3+、Ac-、NO3- |
| A. | KCl | B. | Cu2(OH)2CO3 | C. | Na2CO3 | D. | NaOH |
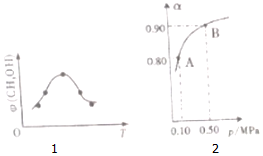 科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H
科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H