题目内容
1.在实验室中,用足量的CO还原16.0g某种氧化物,将生成的气体通入足量的澄清石灰水中生成30.0g沉淀,则该氧化物可能是( )| A. | FeO | B. | Fe2O3 | C. | CuO | D. | Cu2O |
分析 在实验室中,用足量的CO还原16.0g某种氧化物,生成气体为二氧化碳,将生成的二氧化碳气体通入足量澄清石灰水中,得到30g沉淀为碳酸钙,碳酸钙的物质的量=$\frac{30g}{100g/mol}$=0.3mol,反应中CO分子获得1个O原子生成1个CO2分子,则金属氧化物中n(O)=n(CO2)=0.3mol,该氧化物中含有氧元素的质量为:m(O)=0.3mol×16g/mol=4.8g,金属氧化物中金属元素的质量为:16g-4.8g=11.2g,则金属氧化物中m(金属):m(O)=11.2g:4.8g=7:3,据此结合选项验证判断.
解答 解:用足量的CO还原16g某种金属氧化物,生成气体为二氧化碳,将生成的二氧化碳通入足量的澄清石灰水中,得到30g沉淀为碳酸钙,碳酸钙的物质的量=$\frac{30g}{100g/mol}$=0.3mol,反应中CO分子获得1个O原子生成1个CO2分子,则金属氧化物中n(O)=n(CO2)=0.3mol,m(O)=0.3mol×16g/mol=4.8g,金属氧化物中金属元素的质量为:16g-4.8g=11.2g,则金属氧化物中m(金属):m(O)=11.2g:4.8g=7:3,
A.FeO中m(Fe):m(O)=56:16=7:2,故A错误;
B.Fe2O3中m(Fe):m(O)=2×56:3×16=7:3,故B正确;
C.CuO中m(Cu):m(O)=64:16=4:1,故C错误;
D.Cu2O中m(Cu):m(O)=2×64:16=8:1,故D错误;
故选B.
点评 本题考查化学方程式的计算,题目难度中等,根据反应确定氧化物中含有氧元素的质量是解题关键,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
相关题目
10.已知还原性:Fe2+>Br-,向100mlFeBr2溶液中通入3.36L(标准状况下)Cl2,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原溶液中FeBr2的物质的量浓度为( )
| A. | 2mol/L | B. | 1.5mol/L | C. | 1mol/L | D. | 0.5mol/L |
8.下列关于萃取和蒸馏的说法中,正确的有( )
| A. | 用乙醇萃取溴水中的溴单质可选用分液漏斗 | |
| B. | 为了保证冷凝效果,蒸馏操作时冷凝水流向要与蒸馏水流动方向相同 | |
| C. | 蒸馏操作时温度计的水银球要与圆底烧瓶的支管口相平 | |
| D. | 分液时,需将分液漏斗上口的塞子打开或使玻璃凹槽和小孔连通 |
15.下列反应的现象描述与离子方程式都正确的是( )
| A. | 金属铁与盐酸反应;有气泡逸出2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氢氧化钡溶液与稀硫酸反应;有白色沉淀生成Ba2++SO42-═BaSO4↓ | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生 HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 碳酸镁与盐酸反应:有气泡逸出CO32-+2H+═CO2↑+H2O |
6.辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2).一种以辉铜矿石为原料制备硝酸铜的工艺流程如图:
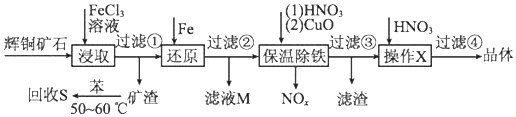
已知部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
(1)写出步骤“还原”中可能发生反应的离子方程式Fe+2Fe3+=3Fe2+;Fe+Cu2+=Cu+Fe2+.
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是温度高苯容易挥发、温度低溶解速率小.
(3)保温除铁过程中加入CuO的目的是调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀.
(4)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体.操作X是蒸发浓缩、冷却结晶(填操作名称).

已知部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是温度高苯容易挥发、温度低溶解速率小.
(3)保温除铁过程中加入CuO的目的是调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀.
(4)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体.操作X是蒸发浓缩、冷却结晶(填操作名称).
10.下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
| A. | 2-甲基丙烷 | B. | 环戊烷 | ||
| C. | 2,2,3,3-四甲基丁烷 | D. | 3-甲基戊烷 |
 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
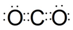 ;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.
;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.