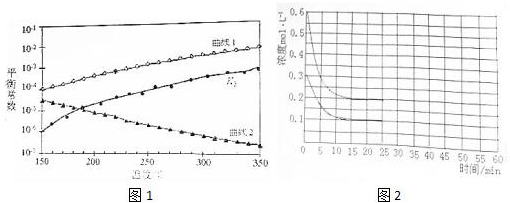
题目内容
20.下列各组离子中,在给定条件下能够大量共存的是( )| A. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| D. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- |
分析 A.c(H+)/c(OH-)=1012的溶液,显酸性;
B.MnO4-为紫色;
C.离子之间发生氧化还原反应;
D.通入足量CO2后的溶液,显酸性.
解答 解:A.c(H+)/c(OH-)=1012的溶液,显酸性,该组离子之间不反应,可大量共存,故A选;
B.MnO4-为紫色,与无色不符,故B不选;
C.H+、ClO?、I?发生氧化还原反应,不能共存,故C不选;
D.通入足量CO2后的溶液,显酸性,不能大量存在SiO32-、CO32-,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
8.下列化学反应中,属于吸热反应的是( )
| A. | 木炭燃烧反应 | B. | 稀硫酸与烧碱反应 | ||
| C. | 生石灰与水反应 | D. | Ba(OH)2•8H2O与NH4Cl晶体 |
15.“混盐”是指一种金属离子与多种酸根离子构成的盐,氯化硝酸钙[Ca(NO3)Cl]就是一种混盐.“复盐”是指含有两种或者两种以上金属阳离子和一种酸根离子构成的盐如KA1(SO4)2•12H2O.下列化合物中属于混盐的是( )
| A. | CaOCl2 | B. | (NH4)2Fe(SO4)2 | C. | Na3A1F6 | D. | Cu2(OH)2CO3 |
5.下表中关于物质分类的正确组合是( )
| 类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
| A | CO | CuO | H2SO4 | NH3•H2O | Na2S |
| B | CO2 | Na2O | HCl | NaOH | NaCl |
| C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
| D | NO2 | CaO | HNO3 | Cu(OH)2CO3 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
12.在蒸发皿中将下列盐溶液蒸干并灼烧,能得到该物质的固体的是( )
| A. | 氯化铝 | B. | 碳酸氢钠 | C. | 硫酸镁 | D. | 亚硫酸钠 |
9.下列各溶液中一定能大量共存的离子组是( )
| A. | 使酚酞试液呈红色的溶液中:K+、Na+、SO42-、NO3- | |
| B. | 使pH试纸呈红色的溶液中:Fe3+、Na+、SCN-、Cl- | |
| C. | 0.1mol/LNaHCO3溶液中:K+、AlO2-、SO42-、NO3- | |
| D. | 加入Al粉能产生H2的溶液中:K+、Na+、AlO2-、CO32- |
 A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$倍;C与E同主族.
A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$倍;C与E同主族.