题目内容
在1L密闭容器发生反应:4NH3(g)+5O2(g)?4NO(g)+6HO(g)△H=-Q kJ?mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
下列说法错误的是( )
| 时间/浓度 | c(NH3)(mol?L-1) | c(O2)(mol?L-1) | c(NO)(mol?L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A、反应在第2min到第4min时,O2的平均速率为0.1875mol?L-1?min-1 |
| B、反应在第2min时改变了某一条件,该条件可能是使用催化剂或升高温度 |
| C、第4min、第8min时分别达到化学平衡,且平衡常数相同 |
| D、在开始反应的前2min内,该反应放出0.05QKJ的热量 |
考点:化学平衡建立的过程
专题:化学平衡专题
分析:A、在反应4NH3(g)+5O2(g)?4NO(g)+6HO(g)中,第2min时,氨气浓度变化了0.2mol?L-1,所以氧气的浓度变化为
×0.2mol?L-1=0.25mol?L-1,所以a=1.35mol?L-1,根据v=
计算氧气的反应速率;
B、在第2min到第4min时,△c(NH3):△c(O2):△c(NO)=(0.6-0.3):(1.35-0.975):(0.5-0.2)=4:5:4,与反应中计量数一致,所以它们的起始量没有改变,平衡向正反应方向移动,改变的条件也可以是减小水的浓度;
C、因为反应的温度没有变,所以化学平衡常数不变;
D、在开始反应的前2min内,氨气的物质的量的变化量为0.2mol/L×1L=0.2mol,根据热化学方程式要知,放出的热量为0.2×
KJ=0.05QKJ的热量.
| 5 |
| 4 |
| △c |
| △t |
B、在第2min到第4min时,△c(NH3):△c(O2):△c(NO)=(0.6-0.3):(1.35-0.975):(0.5-0.2)=4:5:4,与反应中计量数一致,所以它们的起始量没有改变,平衡向正反应方向移动,改变的条件也可以是减小水的浓度;
C、因为反应的温度没有变,所以化学平衡常数不变;
D、在开始反应的前2min内,氨气的物质的量的变化量为0.2mol/L×1L=0.2mol,根据热化学方程式要知,放出的热量为0.2×
| Q |
| 4 |
解答:
解:A、在反应4NH3(g)+5O2(g)?4NO(g)+6HO(g)中,第2min时,氨气浓度变化了0.2mol?L-1,所以氧气的浓度变化为
×0.2mol?L-1=0.25mol?L-1,所以a=1.35mol?L-1,根据v=
计算氧气的反应速率为
mol?L-1?min-1=0.1875mol?L-1?min-1,故A正确;
B、在第2min到第4min时,△c(NH3):△c(O2):△c(NO)=(0.6-0.3):(1.35-0.975):(0.5-0.2)=4:5:4,与反应中计量数一致,所以它们的起始量没有改变,平衡向正反应方向移动,改变的条件也可以是减小水的浓度,故B错误;
C、因为反应的温度没有变,所以化学平衡常数不变,故C正确;
D、在开始反应的前2min内,氨气的物质的量的变化量为0.2mol/L×1L=0.2mol,根据热化学方程式要知,放出的热量为0.2×
KJ=0.05QKJ的热量,故D正确;
故选B.
| 5 |
| 4 |
| △c |
| △t |
| 1.35-0.975 |
| 2 |
B、在第2min到第4min时,△c(NH3):△c(O2):△c(NO)=(0.6-0.3):(1.35-0.975):(0.5-0.2)=4:5:4,与反应中计量数一致,所以它们的起始量没有改变,平衡向正反应方向移动,改变的条件也可以是减小水的浓度,故B错误;
C、因为反应的温度没有变,所以化学平衡常数不变,故C正确;
D、在开始反应的前2min内,氨气的物质的量的变化量为0.2mol/L×1L=0.2mol,根据热化学方程式要知,放出的热量为0.2×
| Q |
| 4 |
故选B.
点评:本题主要考查了化学反应速率计算、影响平衡移动的条件、平衡常数的影响因素、反应热的计算,难度中等,解题时注意根据表中数据正确运算.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案
相关题目
下列热化学方程式中△H表示可燃物燃烧热的是( )
A、C(s)+
| ||
| B、2H2(g)+O2(g)═2H2O(g)△H═-571.6kJ/mol | ||
| C、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-802.3kJ/mol | ||
| D、C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(I)△H═-2800kJ/mol |
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )
| A、4KI+O2+2H2O═4KOH+2I2 | ||||
| B、2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | ||||
| C、I2+2NaClO3═2NaIO3+Cl2 | ||||
D、MnO2+4HCl
|
某单质能与足量浓HNO3反应放出NO2气体,若参加反应的单质和硝酸的物质的量之比为1:a,则该元素在反应中所显示的化合价是 ( )
| A、+2a | ||
| B、+a | ||
C、+
| ||
D、+
|
下列除杂质试剂的选择,不正确的是(括号内为除杂试剂)( )
| A、KHCO3溶液中混有K2CO3 ( CO2 ) |
| B、Mg中混有Al ( NaOH溶液 ) |
| C、Fe2O3中混有Al2O3 ( NaOH溶液) |
| D、Fe中混有Fe2O3 ( 盐酸 ) |
某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:n(NO3-):n(SO42-):n(Fe3+):n(H+):n(X)=2:3:1:3:1,则X可能为( )
| A、Fe2+ |
| B、Mg2+ |
| C、Cl- |
| D、Ba2+ |
某溶液中加入铝粉,有H2放出,在该溶液中一定能大量共存的离子组是( )
| A、K+、Na+、Cl-、SO42- |
| B、Na+、NH4+、SO42-、HCO3- |
| C、Na+、Ba2+、NO3-、Cl- |
| D、K+、Na+、NO3-、AlO2- |
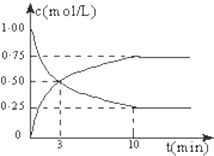 在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示:
在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示: 某校学习小组进行下述实验,探究CH3COOH、H2CO3和H2SiO3
某校学习小组进行下述实验,探究CH3COOH、H2CO3和H2SiO3