��Ŀ����
1���ȣ�Sr��Ϊ�������ڢ�A��Ԫ�أ��仯������ˮ�Ȼ��ȣ�SrCl2•6H2O����ʵ������Ҫ�ķ����Լ�����ҵ�ϳ�������ʯ����Ҫ�ɷ�ΪSrSO4��Ϊԭ���Ʊ��������������£�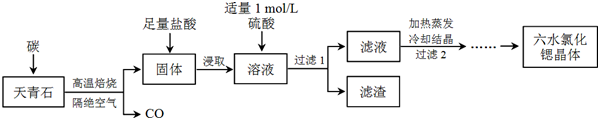
��֪���پ������ȡ����Һ�г�����Sr2+��Cl-�⣬����������Ba2+���ʣ�
��SrSO4��BaSO4���ܶȻ������ֱ�Ϊ3.3��10-7��1.1��10-10��
��SrCl2•6H2O��Ħ������Ϊ��267g/mol��
��1������ʯ����ǰ����ĥ���飬��Ŀ�������ӷ�Ӧ��ĽӴ��������߷�Ӧ���ʣ����ԭ�ϵ�ת����
��2�������������±��գ���0.5mol SrSO4��ֻ��S����ԭ��ת����4mol���ӣ�д���÷�Ӧ�Ļ�ѧ����ʽSrSO4+4C$\frac{\underline{\;����\;}}{\;}$SrS+4CO��
��3��Ϊ�˵õ��ϴ�����ˮ�Ȼ��Ⱦ��壬����2������е�����������ϴ�ӡ�����
��4�����������Ŀ���dz�ȥ��Һ��Ba2+���ʣ�Ϊ�����ԭ�ϵ������ʣ���Һ��Sr2+��Ũ��Ӧ������0.03 mol/L��ע����ʱ��Һ��Ba2+Ũ��Ϊ1��10-5 mol/L����
��5����Ʒ���ȼ�⣺��ȡ1.000g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO31.100��10-2mol��AgNO3��Һ����Һ�г�Cl-�⣬����������Ag+��Ӧ�����ӣ�����Cl-��ȫ�������ú�Fe3+����Һ��ָʾ������0.2000mol/L��NH4SCN����Һ�ζ�ʣ���AgNO3��ʹʣ���Ag+��AgSCN��ɫ��������ʽ�������ٵζ���Ӧ�ﵽ�յ����������Һ����ɫ��ΪѪ��ɫ����30s����ɫ��
�����ζ�������ȥ����Ũ�ȵ�NH4SCN��Һ20.00mL�����Ʒ��SrCl2•6H2O�������ٷֺ���Ϊ93.45%������4λ��Ч���֣���
���� ������ʯ����Ҫ�ɷ�ΪSrSO4��Ϊԭ���Ʊ���ˮ�Ȼ��ȣ�SrCl2•6H2O���������̿�֪������ʯ��̼�����������±�������CO��SrS��SrS���������Һ�г�����Sr2+��Cl-�⣬����������Ba2+���ʣ�Ȼ��������������ᱵ���������Թ��˺�����Ϊ���ᱵ����Һ�к�SrSO4��SrCl2�������������ȴ�ᾧ�õ�SrCl2•6H2O��
��1����ĥ�����Ŀ�������ӷ�Ӧ��ĽӴ��������߷�Ӧ���ʣ����ԭ�ϵ�ת���ʣ�
��2��0.5mol SrSO4��ֻ��S����ԭ��ת����4mol���ӣ���1mol��Sת��8mol�ĵ��ӣ���Ӧ�����ɵ�-2�������ӣ��ݴ�д���÷�Ӧ�Ļ�ѧ����ʽ��
��3������1�����Һ�к����Ȼ��ȣ�����Һ����Ũ������ȴ�ᾧ��Ȼ�����Һ�н�������˳�����ϴ�ӳ�ȥ������������Ӳ����и��T���SrCl2•6H2O��
��4����HCl�ܽ�SrS�����Һ�к������ʱ����ӣ���������ĺ��������ᱵ�����Ӷ���ȥ��Һ��Ba2+���ʣ�
���ݱ�����Ũ�ȡ����ᱵ���ܶȻ��������������ȫ��ȥʱ��������ӵ�Ũ�ȣ�Ȼ����������ȵ��ܶȻ��������Ҫ�����ӵ���СŨ�ȣ�
��5������NH4SCN����ʣ���Ag+����γ�AgSCN��ɫ��������Һ�оͻẬ��SCN-���ͻ���Fe3+�������������Һ��Ϊ��ɫ���ݴ��жϵζ��յ㣻
�ڸ���n=cV�����n��NH4SCN����Ag+��AgSCN��ɫ��������ʽ�������ݴ˼������Һ��ʣ���Ag+�����ʵ�������Cl-��Ӧ��Ag+�����ʵ������ٸ����������غ�����1.000g��Ʒ��SrCl2•6H2O�����ʵ��������������������Ʒ���ȣ�
��� �⣺��1������ʯ����ǰ����ĥ���飬��Ŀ����Ϊ�����ӷ�Ӧ��ĽӴ���������ѧ��Ӧ���ʣ��Ӷ����ԭ�ϵ�ת���ʣ�
�ʴ�Ϊ�����ӷ�Ӧ��ĽӴ��������߷�Ӧ���ʣ����ԭ�ϵ�ת���ʣ�
��2���ڱ��յĹ�������ֻ��0.5 mol SrSO4��ֻ��S����ԭ��ת����4 mol���ӣ���1mol��Sת��8mol�ĵ��ӣ������ڷ�ӦǰԪ�صĻ��ϼ�Ϊ+6�ۣ����Է�Ӧ��Ԫ�صĻ��ϼ�Ϊ-2�ۣ����̼������ʯ�ڸ����·�����Ӧ�Ļ�ѧ����ʽΪ��SrSO4+4C$\frac{\underline{\;����\;}}{\;}$SrS+4CO����
�ʴ�Ϊ��SrSO4+4C$\frac{\underline{\;����\;}}{\;}$SrS+4CO����
��3��Ȼ����õ��ĺ���SrS�����м���HCl������Ӧ��SrS+2HCl=SrCl2+H2S��������Һ����Ũ������ȴ�ᾧ��Ȼ�����Һ�н�������˳�����ϴ�ӳ�ȥ������������Ӳ����и��T���SrCl2•6H2O��
�ʴ�Ϊ��ϴ�ӡ����
��4������HCl�ܽ�SrS�����Һ�м��������Ŀ���dz�ȥ��Һ��Ba2+���ʣ�
������Ba2+Ũ��Ϊ1��10-5 mol/L��BaSO4���ܶȻ�����Ϊ1.1��10-10������c��SO42-��=$\frac{1.1��10{\;}^{-10}}{1��10{\;}^{-5}}$mol/L=1.1��10-5mol/L����SrSO4���ܶȻ�����Ϊ3.3��10-7������c��Sr2+��=$\frac{3.3��10{\;}^{-7}}{1.1��10{\;}^{-5}}$mol/L=3.0��10-2=0.03mol/L��
�ʴ�Ϊ����ȥ��Һ��Ba2+���ʣ� 0.03��
��5������NH4SCN����ʣ���Ag+����γ�AgSCN��ɫ��������Һ�оͻẬ��SCN-���ͻ���Fe3+�������������Һ��Ϊ��ɫ����˵ζ��ﵽ�յ�ʱ��Һ����ɫ��ΪѪ��ɫ����30 s����ɫ��
�ʴ�Ϊ����Һ����ɫ��ΪѪ��ɫ����30 s����ɫ��
��n��NH4SCN��=0.2000mol/L��0.02L=4.0��10-3mol��Ag+��AgSCN��ɫ��������ʽ������������Һ��ʣ���Ag+�����ʵ���Ϊ��n��Ag+��=4.0��10-3mol������Cl-��Ӧ��Ag+�����ʵ���Ϊ��n��Ag+��=1.100��10-2 mol-4.0��10-3mol=7.0��10-3mol��
1.000g��Ʒ��SrCl2•6H2O�����ʵ���Ϊ��n��SrCl2•6H2O��=$\frac{1}{2}$��n��Ag+��=3.5��10-3mol��
1.000g��Ʒ��SrCl2•6H2O������Ϊ��m��SrCl2•6H2O��=3.5��10-3mol��267 g/mol=0.9345g��
���Բ�Ʒ����Ϊ��$\frac{0.9435g}{1g}$��100%=93.45%��
�ʴ�Ϊ��93.45%��
���� ���⿼���Ʊ�ʵ�鷽������ƣ�Ϊ��Ƶ���㣬�����Ʊ������з����Ļ�ѧ��Ӧ�����ʷ��뷽��Ϊ���Ĺؼ����漰��Ӧ���ʡ�������ԭ��Ӧ���ζ�ԭ���ȣ�ע����Ϣ����ѧ֪ʶ���ۺ�Ӧ�ã��ۺ��Խ�ǿ����Ŀ�ѶȽϴ�

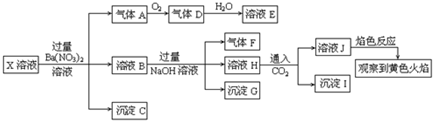
���н�����ȷ���ǣ�������
| A�� | X�п϶�����Na+��Fe2+��A13+��NH4+��SO42- | |
| B�� | ����F����������ֱ����������D | |
| C�� | ����Cһ����BaSO4������Gһ����Fe��OH��3������I������Al��OH ��3 | |
| D�� | X�в���ȷ����������Na+��K+��C1- |
| A�� | N2��NH3 | B�� | MnO2��MnCl2 | C�� | KI��KIO3 | D�� | SO2��H2S |
| A�� | 0.1 mol•L-1��CH3COOH | B�� | 0.1 mol•L-1��NaHSO4 | ||
| C�� | 0.1 mol•L-1��NaHCO3 | D�� | 0.05 mol•L-1��H2SO3 |
| A�� | ijЩ�����ĵ��ʺͻ������ڻ���������ʱ���������������ɫ�������ɫ��Ӧ��Ԫ�ص����� | |
| B�� | �ص���ɫΪ��ɫ������ͨ����ɫ�ܲ������ܹ۲쵽 | |
| C�� | ��ɫ��Ӧ���������̣���Ҳ���ܰ����Ż�ѧ�仯 | |
| D�� | �̻������ֳ�������ɫ�����̻��к���ijЩ����Ԫ�ص������й� |
| A�� | ������˥�ߵȼ��������ѪҺ�ж���������ѪҺ���������� | |
| B�� | �������������һ������磬������NH4+��Ӫ�����ӣ�ʹ�������б������� | |
| C�� | ˮ�ࡢұ���ø�ѹ���ȥ�����̳������ٶԿ�������Ⱦ | |
| D�� | �Ȼ�����Һ�м���С�մ���Һ�������ɫ���������� |