题目内容
9.下列变化需要加入氧化剂才能实现的是( )| A. | N2→NH3 | B. | MnO2→MnCl2 | C. | KI→KIO3 | D. | SO2→H2S |
分析 需要加入氧化剂才能实现,说明给予物质作还原剂,在反应中失电子化合价升高,据此分析解答.
解答 解:A.该反应中N元素化合价由0价变为-3价,所以氮气是氧化剂,需要还原剂氢气才能实现,故A错误;
B.该反应中Mn元素化合价由+4价变为+2价,所以二氧化锰是氧化剂,需要还原剂浓盐酸才能实现,故B错误;
C.该反应中I元素化合价由-1价变为+5价,所以KI是还原剂,需要氧化剂才能实现,故C正确;
D.该反应中S元素化合价由+4价变为-2价,所以二氧化硫是氧化剂,需要还原剂才能实现,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,明确元素化合价变化与元素性质关系是解本题关键,知道常见元素化合价,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列设计的实验方案能达到实验目的是( )
| A. | 工业上制取漂白粉:向澄清石灰水中通入足量的Cl2 | |
| B. | 验证醋酸是弱电解质:常温下测定0.1 mol•L-1醋酸钠溶液的pH | |
| C. | 探究FeCl3和KI溶液反应限度:向5mL0.1 mol•L-1 FeCl3溶液中加入0.1 mol•L-1KI溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象 | |
| D. | 检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象 |
14.某无色透明溶液能与铝作用放出氢气,且溶液中的离子能大量共存的是( )
| A. | K+、NO3-、OH-、Cl- | B. | Cu2+、SO42-、H+、Na+ | ||
| C. | H+、Ba2+、Mg2+、NO3- | D. | NH4+、MnO4-、H+、K+ |

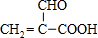

 ;
;