题目内容
14.下列实验操作中,不能用于物质分离的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 A.图为过滤装置;
B.图为蒸馏装置;
C.图为萃取操作;
D.图为分液装置.
解答 解:A.图为过滤装置,用于分离不溶性固体与液体,故A不选;
B.图为蒸馏装置,用于分离互溶但沸点不同的液体混合物,故B不选;
C.图为萃取操作,利用了同种溶质在不同溶剂中的溶解性差异原理,但该操作未分离出物质,故C选;
D.图为分液装置,用于分层液体的分离,故D不选;
故选C.
点评 本题考查化学实验操作及评价,为高频考点,把握混合物分离提纯实验装置、实验原理为解答的关键,侧重分析与实验能力的考查,注意萃取、分液常组合使用,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
4.A元素原子的L电子层比B元素原子的L电子层少3个电子,B元素原子核外总电子数比A元素原子电子总数多5个,则A、B形成化合物可能是( )
| A. | 离子化合物AB | B. | 离子化合物B2A3 | C. | 离子化合物B(AO3)2 | D. | 离子化合物A2BO3 |
2.如表为元素周期表短周期的一部分,请用化学用语(元素符号或化学式)回答相关问题:
(1)⑥元素在周期表中的位置为第三周期第ⅢA族.
(2)表中序号元素中半径最大的常见离子是S2-.
(3)表中最高价氧化物对应水化物的碱性最强的物质的电子式为 ,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.
,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.
(4)元素非金属性强弱比较有很多方法,其中③和⑧的非金属性强弱的探究方案中不可行的是A(填序号)
A.比较两种氢化物的熔沸点高低 B.比较氢化物的稳定性
C.通过和铁反应,比较得电子能力 D.通过置换反应
(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,请写出该分子的电子式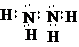 .
.
(6)⑦与⑨两元素的单质反应生成1mol⑦的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
| ① | |||||||
| ② | ③ | ④ | |||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)表中序号元素中半径最大的常见离子是S2-.
(3)表中最高价氧化物对应水化物的碱性最强的物质的电子式为
 ,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.
,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.(4)元素非金属性强弱比较有很多方法,其中③和⑧的非金属性强弱的探究方案中不可行的是A(填序号)
A.比较两种氢化物的熔沸点高低 B.比较氢化物的稳定性
C.通过和铁反应,比较得电子能力 D.通过置换反应
(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,请写出该分子的电子式
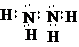 .
.(6)⑦与⑨两元素的单质反应生成1mol⑦的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
19.表为元素周期表的一部分
回答下列问题
(1)Y元素在周期表中的位置为第二周期第ⅤIA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实不能说明Z 元素的非金属性比S 元素的非金属性强的是:b
a.Z的单质与H2S溶液反应,溶液变浑浊
b.Z的含氧酸HZO3酸性比H2SO4强
c.Z和S两元素的简单氢化物受热分解,前者的分解温度高
d.化合物SZ2中S显正价,Z显负价
(4)表中某元素的最高价含氧酸与其气态氢化物反应生成一种盐,该盐所含化学键的类型为离子键、共价键.
(5)碳、Y和硫三种元素按1:l:l个数比形成化合物,每个原子都达到8电子的稳定结构,该化合物的电子式为 .
.
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成两种有毒气体,均由表中两种元素组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/LNaOH溶液和lmolO2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Y元素在周期表中的位置为第二周期第ⅤIA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实不能说明Z 元素的非金属性比S 元素的非金属性强的是:b
a.Z的单质与H2S溶液反应,溶液变浑浊
b.Z的含氧酸HZO3酸性比H2SO4强
c.Z和S两元素的简单氢化物受热分解,前者的分解温度高
d.化合物SZ2中S显正价,Z显负价
(4)表中某元素的最高价含氧酸与其气态氢化物反应生成一种盐,该盐所含化学键的类型为离子键、共价键.
(5)碳、Y和硫三种元素按1:l:l个数比形成化合物,每个原子都达到8电子的稳定结构,该化合物的电子式为
 .
.(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成两种有毒气体,均由表中两种元素组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/LNaOH溶液和lmolO2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
3.设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 常温下1L0.1mol•L-1NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1molH2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略):A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D,若A是共价化合物,0.1molA分子中含有的质子数可能为NA | |
| D. | 用足量CO还原磁铁矿得到9mol铁时转移24mol电子 |
18.氟利昂12是甲烷的氯、氟卤代物,结构式为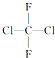 下列有关叙述正确的是( )
下列有关叙述正确的是( )
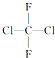 下列有关叙述正确的是( )
下列有关叙述正确的是( )| A. | 它有两种同分异构体 | B. | 它是平面分子 | ||
| C. | 它只有一种结构 | D. | 它有4种同分异构体 |
 ;
;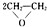 ;
;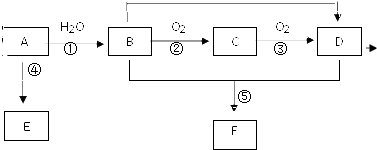 已知 A 的产量通常用来衡量一个国家的石油化工水平,现以 A 为主要原料合成高分子化合物 E 和一种具有果香味的物质 F,其合成路线如图所示.
已知 A 的产量通常用来衡量一个国家的石油化工水平,现以 A 为主要原料合成高分子化合物 E 和一种具有果香味的物质 F,其合成路线如图所示.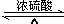 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$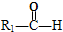 +
+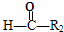 ,
,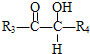 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$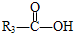 +
+
 .
. .
.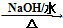 HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO
HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO 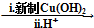 HCOOH
HCOOH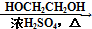 HCOOCH2CH2OOCH(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)
HCOOCH2CH2OOCH(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)