题目内容
8. 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:| 元素 | 相关信息 |
| T | 基态原子2p能级有3个单电子 |
| W | 基态原子p轨道上成对电子数等于未成对电子数 |
| X | 氢化物常用于刻蚀玻璃 |
| Y | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
| Z | 原子序数等于X与Y的原子序数之和 |
(2)42gT的单质分子中π键的个数为3NA;在T的最简单氢化物分子中T原子的杂化类型是sp3.研究者预想合成一个纯粹由T元素组成的新物种T5+T3-,若T5+离子中每个氮原子均满足8电子且呈对称结构,以下有关T5+推测正确的是BD(填序号)
A.N5+有24个电子
B.N5+阳离子中存在两个氮氮三键
C.N5+离子中存在三对未成键的电子对
D.N3-离子的空间构型为直线型
(3)TX3是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.它可在Z单质的催化作用下由X2和过量的TH3反应得到,试写出该反应的化学方程式:4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F.在该反应方程式中的几种物质所属的晶体类型有acd(填序号).
a.离子晶体 b.原子晶体 c.分子晶体 d.金属晶体
(4)T、W、X 3种元素的电负性由大到小的顺序为F>O>N(用元素符号表示).
(5)Z2+能与T的氢化物写出配位数为4的配离子[Z(TH3)4]2+,该配离子具有对称的空间构型,且离子中的两个TH3被两个Cl取代只能得到一种产物,则[Z(TH3)4]2+的空间构型为正四面体.
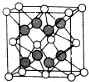
(6)X和Y形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g•cm-3,阿伏加德罗常数为NA,则晶胞边长a=$\root{3}{\frac{312ρ}{{N}_{A}}}$cm.(用ρ、NA的计算式表示).
分析 T基态原子2p能级有3个单电子,则T为N元素;
W基态原子p轨道上成对电子数等于未成对电子数,则W为O元素;
X氢化物常用语雕刻玻璃,则X为F元素;
Y基态原子核外电子分处6个不同能级,且每个能级均已排满,则Y为Ca元素;
Z原子序数等于X与Y原子序数之和,则Z为原子序数为9+20=29,则Z为Cu元素;
(1)元素Y为Ca元素,其原子核外有20个电子,根据构造原理书写其基态原子的核外电子排布式;
(2)42gN元素的单质物质的量=$\frac{42g}{28g/mol}$=1.5mol,一个氮气分子中含有2个π键,则1.5mol氮气中含有3molπ键;在N元素的最简单氢化物分子中T原子价层电子对个数是4且含有1个孤电子对,根据构造原理判断N原子的杂化类型;
A.阳离子核外电子数=质子总数-电荷数;
B.N5+离子的结构为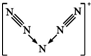 ;
;
C.N5+ 离子中每个氮原子均满足8电子且呈对称结构,N5+离子的结构为 ,中间N原子有2对孤对电子;
,中间N原子有2对孤对电子;
D.N3-离子与二氧化碳分子核外等电子体;
(3)在Cu单质的催化作用下由F2和过量的NH3反应得到N5+N3-,根据反应物和生成物及反应条件书写该反应的化学方程式;在该反应方程式中的几种物质所属的晶体类型有分子晶体、金属晶体和离子晶体;
(4)N、O、F3种元素位于同一周期,同一周期元素的电负性随着原子序数增大而呈增大趋势;
(5)Cu2+能与N的氢化物写出配位数为4的配离子[Cu(NH3)4]2+,该配离子具有对称的空间构型,且离子中的两个NH3被两个Cl-取代只能得到一种产物,则[Cu(NH3)4]2+的空间构型正四面体结构;
(6)X和Y形成的化合物的晶胞结构如图所示,根据图知,黑色球表示氟离子、白色球表示钙离子,该晶胞中钙离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氟离子个数为8,其化学式为CaF2,$V=\frac{\frac{M}{{N}_{A}}×4}{ρ}$.
解答 解:T基态原子2p能级有3个单电子,则T为N元素;
W基态原子p轨道上成对电子数等于未成对电子数,则W为O元素;
X氢化物常用语雕刻玻璃,则X为F元素;
Y基态原子核外电子分处6个不同能级,且每个能级均已排满,则Y为Ca元素;
Z原子序数等于X与Y原子序数之和,则Z为原子序数为9+20=29,则Z为Cu元素;
(1)元素Y为Ca元素,其原子核外有20个电子,根据构造原理书写其基态原子的核外电子排布式为1s22s22p63s23p64s2(或[Ar]4s2),
故答案为:1s22s22p63s23p64s2(或[Ar]4s2);
(2)42gN元素的单质物质的量=$\frac{42g}{28g/mol}$=1.5mol,一个氮气分子中含有2个π键,则1.5mol氮气中含有3molπ键,含有π键3NA个;在N元素的最简单氢化物分子中T原子价层电子对个数是4且含有1个孤电子对,根据构造原理判断N原子的杂化类型为sp3,
A.阳离子核外电子数=质子总数-电荷数,N5+电子数=5×7-1=34,故错误;
B.N5+离子的结构为 ,N5+阳离子中存在两个氮氮三键,故正确;
,N5+阳离子中存在两个氮氮三键,故正确;
C.N5+ 离子中每个氮原子均满足8电子且呈对称结构,N5+离子的结构为 ,中间N原子有2对孤对电子,边上的两个N原子分别含有1对孤电子对,所以有4对孤电子对,故错误;
,中间N原子有2对孤对电子,边上的两个N原子分别含有1对孤电子对,所以有4对孤电子对,故错误;
D.N3-离子与二氧化碳分子核外等电子体,为直线形,故正确;
故答案为:3NA;sp3;BD;
(3)在Cu单质的催化作用下由F2和过量的NH3反应得到N5+N3-,根据反应物和生成物及反应条件书写该反应的化学方程式为4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F;在该反应方程式中的几种物质所属的晶体类型有分子晶体、金属晶体和离子晶体,氨气、氟气和三氟化氮为分子晶体,氟化铵为离子晶体、Cu为金属晶体,
故答案为:4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F;acd;
(4)N、O、F3种元素位于同一周期,同一周期元素的电负性随着原子序数增大而呈增大趋势,所以电负性大小顺序是F>O>N,故答案为:F>O>N;
(5)Cu2+能与N的氢化物写出配位数为4的配离子[Cu(NH3)4]2+,该配离子具有对称的空间构型,且离子中的两个NH3被两个Cl-取代只能得到一种产物,则[Cu(NH3)4]2+的空间构型正四面体结构,故答案为:正四面体;
(6)X和Y形成的化合物的晶胞结构如图所示,根据图知,黑色球表示氟离子、白色球表示钙离子,该晶胞中钙离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氟离子个数为8,其化学式为CaF2,$V=\frac{\frac{M}{{N}_{A}}×4}{ρ}$,则晶胞边长a=$\root{3}{\frac{\frac{M}{{N}_{A}}×4}{ρ}}$=$\root{3}{\frac{312ρ}{{N}_{A}}}$cm,
故答案为:$\root{3}{\frac{312ρ}{{N}_{A}}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、微粒空间构型判断、元素周期律、原子杂化方式判断等知识点,综合性较强,明确物质或微粒结构、元素周期律内涵、价层电子对互斥理论是解本题关键,同时考查学生分析判断及计算能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案 现有苯的同系物,其蒸气密度为H2的60倍,该烃经氧化后,其产物1mol可中和3mol NaOH,则该烃的结构可能有( )
现有苯的同系物,其蒸气密度为H2的60倍,该烃经氧化后,其产物1mol可中和3mol NaOH,则该烃的结构可能有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| 选项 | 实验操作及现象 | 结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中一定含有钾元素, 可能含钠元素 |
| B | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32- |
| C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
| D | 向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度大于Mg(OH)2的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
| A. | CH3CH2CH3与 | B. | CH2=CH2与 | ||
| C. |  与 与 | D. |  与 与 |

已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
①加入石灰乳调节pH到约3.2,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除尽;
②将浊液加热到 80℃,趁热过滤
(2)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,
(3)当离子浓度小于或等于1×10-5 mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥4.0×10-9mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].
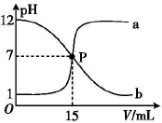
| A. | 盐酸的物质的量浓度与NaOH溶液的物质的量浓度相等 | |
| B. | P点时溶液中c(Na+)=c(Cl-)=c(H+)=c(OH-) | |
| C. | 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线 | |
| D. | 曲线b中滴定前NaOH溶液的体积为150mL |
 工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯
工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯