题目内容
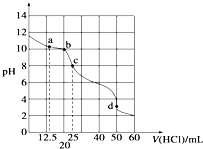 在常温下,0.100 0mol?L-1 Na2CO3溶液25mL用0.100 0mol?L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.100 0mol?L-1 Na2CO3溶液25mL用0.100 0mol?L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A、a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B、b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C、c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
考点:离子浓度大小的比较
专题:
分析:A.a点时n(HCl)=0.1mol/L×0.0125L=0.00125mol,反应生成0.00125molNaHCO3,剩余0.00125molNa2CO3,从盐类的水解程度的角度分析;
B.溶液中存在物料守恒,从物料守恒的角度分析;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3;
D.溶液中满足电荷守恒,根据电荷守恒的角度分析.
B.溶液中存在物料守恒,从物料守恒的角度分析;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3;
D.溶液中满足电荷守恒,根据电荷守恒的角度分析.
解答:
解:A.a点时n(HCl)=0.1mol/L×0.0125L=0.00125mol,反应生成0.00125molNaHCO3,剩余0.00125molNa2CO3,由于水解程度大于电离程度,则c(HCO3-)>c(CO32-),故A错误;
B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,由物料守恒可知5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3),则5c(Cl-)>4c(HCO3-)+4c(CO32-),故B正确;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,由于HCO3-水解程度较弱,则有c(HCO3-)>c(OH-),故C错误;
D.d点时加入盐酸0.005mol,溶液中溶由反应生成的CO2,溶液存在电荷守恒,存在c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-),由于c(Na+)=c(Cl-),则 c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D错误;
故选B.
B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,由物料守恒可知5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3),则5c(Cl-)>4c(HCO3-)+4c(CO32-),故B正确;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,由于HCO3-水解程度较弱,则有c(HCO3-)>c(OH-),故C错误;
D.d点时加入盐酸0.005mol,溶液中溶由反应生成的CO2,溶液存在电荷守恒,存在c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-),由于c(Na+)=c(Cl-),则 c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D错误;
故选B.
点评:本题综合考查离子浓度的大小比较,题目难度较大,本题注意分析反应物的物质的量之间的关系,判断反应的程度以及溶液的主要成分,结合盐类水解的原理解答.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
在密闭容器中进行反应X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol?L-1、0.2mol?L-1、0.2mol?L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.2 mol?L-1 |
| B、Y2为0.35 mol?L-1 |
| C、X2为0.3 mol?L-1 |
| D、Z为0.4 mol?L-1 |
向硝酸钠溶液中加入铜粉不发生反应,若加入某种盐,则铜粉可以逐渐溶解,符合此条件的是( )
| A、Fe(NO3)2 |
| B、ZnSO4 |
| C、NaHCO3 |
| D、NaHSO4 |
向一定浓度的NaHCO3溶液中加入适量下列物质,能使HCO3-数目减少,CO32-数目增加的是( )
| A、稀盐酸 |
| B、Ba(OH)2溶液 |
| C、NaOH溶液 |
| D、Na2SO4溶液 |
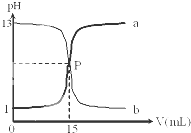 如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空: