题目内容
15.工业上以β-锂辉石(主要成分为Li2O•Al2O3•4SiO2)为原材料制备Li2CO3的工艺流程如下: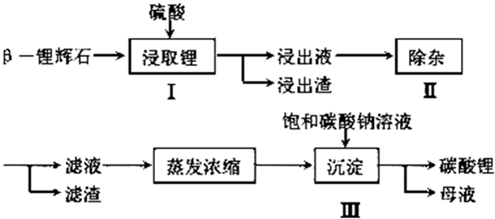
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+等杂质,需在搅拌下加入石灰石以调节溶液的PH到6.0~6.5,过滤,能除去的部分杂质离子是Fe3+、Al3+,然后分离得到浸出液.
(2)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去Fe2+等杂质金属离子,用H2O2将Fe2+除去的离子反应方程式Fe2++2H++2H2O2=2Fe3++2H2O;步骤Ⅱ所得滤渣主要成分的化学式是Fe(OH)3、CaCO3、Mg(OH)2.
(3)Na2SO4•10H2O是工业生产的一种重要化工原料.步骤Ⅲ所得母液溶质主要是Na2SO4和少量NaOH.可以向母液中加入适量的硫酸(或稀硫酸、浓硫酸),再通过蒸发浓缩、冷却结晶、过滤、洗涤,得到Na2SO4•10H2O晶体.
分析 已知β-锂辉石(主要成分为Li2O•Al2O3•4SiO2)为原材料制备Li2CO3的工艺流程:Li2O•Al2O3•4SiO2加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,在在搅拌下加入石灰石调节pH,使Al3+、Fe3+转化为氢氧化物沉淀,过滤,再将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,Fe2+被氧化为Fe3+,然后转化为氢氧化铁沉淀,镁离子转化为氢氧化镁沉淀,钙离子转化为碳酸钙沉淀,过滤的硫酸锂溶液,再加饱和碳酸钠溶液得到碳酸锂沉淀,过滤得到碳酸锂,以此解答该题.
解答 解:(1)结合题干所给信息可知,调节溶液的pH到6.0~6.5时,Fe3+、Al3+已完全沉淀,对应生成的产物为Fe(OH)3、Al(OH)3,故答案为:Fe3+、Al3+;
(2)H2O2在酸性条件下可以将Fe2+氧化为Fe3+,再调节pH将Fe3+转化为Fe(OH)3沉淀而除去.所以,离子反应式为Fe2++2H++2H2O2=2Fe3++2H2O;通过加入H2O2溶液、石灰乳和Na2CO3溶液,剩余的Ca2+转化为CaCO3,而杂质Mg2+则转化为比微溶物MgCO3更难溶解的Mg(OH)2.所以,步骤Ⅱ所得滤渣主要成分是Fe(OH)3、CaCO3、Mg(OH)2,
故答案为:Fe2++2H++2H2O2=2Fe3++2H2O;Fe(OH)3、CaCO3、Mg(OH)2;
(3)将NaOH杂质转化为Na2SO4,可以向母液中加入适量的H2SO4;而为了得到带结晶水的Na2SO4,可以将溶液蒸发浓缩,冷却结晶,
故答案为:硫酸(或稀硫酸、浓硫酸);蒸发浓缩;冷却结晶.
点评 本题考查了物质分离提纯实验操作,为高考常见题型,考查考生运用金属元素的有关知识分析解决问题的能力,涉及离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等,题目难度中等,以实验探究的形式考查元素化合物的性质将成为以后高考命题的新亮点.

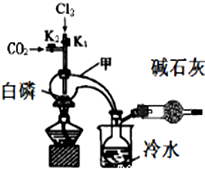 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解.实验室制取PCl3的装置示意图和有关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
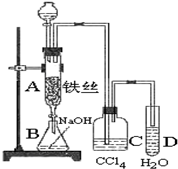
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶、分液漏斗.制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥的将气体通过装有无水硫酸铜的U形管(干燥管),若白色粉末未变蓝,则气体干燥(或者通入装有干燥的有色布条的集气瓶,布条不褪色等,或者将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的,合理答案均可);(写出操作、现象、结论).
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是在甲中先加入白磷,再通入CO2到排尽甲中的空气,向甲中通入Cl2,加热.
(3)E烧杯中加入冷水的目的是冷却PCl3,使其液化,干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气.
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有C(填字母序号).
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)
(已知亚磷酸(H3PO3)是二元弱酸).
②若将0.01 mol POCl3投入热水配成1 L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
 ,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.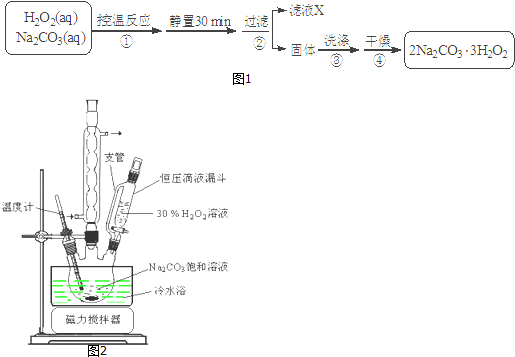
 .
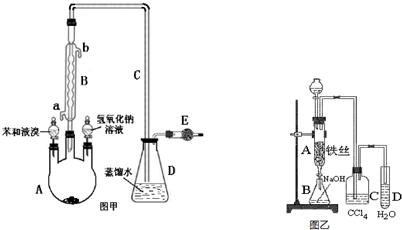
. 实验室用图装置制取少量溴苯,试填写下列空白.
实验室用图装置制取少量溴苯,试填写下列空白.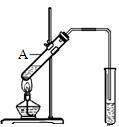 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质: