题目内容
7.直接由原子构成的一组物质是( )| A. | 干冰、二氧化硅、金刚石 | B. | 氧化钠、金刚石、氯化氢 | ||
| C. | 碘、石墨、氯化钠 | D. | 二氧化硅、金刚石、晶体硅 |
分析 根据金属、大多数固态非金属单质、稀有气体单质等由原子构成,有些物质是由分子构成的,如水、氢气等,有些物质是由离子构成的,如氯化钠,进行分析判断即可.
解答 解:A、干冰属于非金属氧化物,是由二氧化碳分子构成的,不是直接由原子构成的,故A错误;
B、Na2O是离子晶体,是由离子构成的,HCl是气体分子,是由分子构成的,故B错误;
C、I2为分子晶体,是由分子构成的;氯化钠是离子晶体,是由离子构成的,故C错误;
D、二氧化硅、金刚石、晶体硅均为原子晶体,均直接由原子构成的,故D正确.
故选D.
点评 本题难度不大,主要考查了构成物质的微观粒子方面的知识,掌握常见物质的粒子构成是正确解答本题的关键.

练习册系列答案
相关题目
17.某食用白醋是由醋酸与纯水配制而成,用0.1000mol/L NaOH溶液准确测定其中醋酸的物质的量浓度.以下为某同学列出的实验步骤(未排序),请回答下列问题.
A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm;
B.调节滴定管液面至0或0刻度以下,记下读数;
C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度;
D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次;
E.用待测醋酸清洗锥形瓶2~3次;
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好;
G.滴定管检漏,用水清洗所有仪器,备用;
H.通过酸式滴定管向锥形瓶注入20.00mL待测醋酸,并加入2-3滴指示剂.
(1)用离子方程式表示该实验的原理CH3COOH+OH-=CH3COO-+H2O.
(2)从上述实验步骤中选出正确的并按操作先后排序.你的实验顺序为:(用字母表示)G→D→A→F→B→H→C.
(3)实验室常用的酸碱指示剂有甲基橙、石蕊和酚酞,你选择的指示剂是酚酞,理由是两者恰好完全中和生成醋酸钠,其水溶液呈碱性,必需选择在碱性范围变色且颜色容易判断的酚酞作指示剂判断滴定终点;滴定终点的现象是无色溶液变浅红色且半分钟内不褪色.
(4)某同学实验后得到的数据如表:
原白醋中醋酸的物质的量浓度为0.07500mol/L(结果保留4位有效数字).
(5)分析下列操作对测定结果的影响,用“偏低”、“偏高”或“不影响”填空.
①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡偏低;
②读取标准溶液体积时,滴定前平视,滴定后仰视偏高.
A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm;
B.调节滴定管液面至0或0刻度以下,记下读数;
C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度;
D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次;
E.用待测醋酸清洗锥形瓶2~3次;
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好;
G.滴定管检漏,用水清洗所有仪器,备用;
H.通过酸式滴定管向锥形瓶注入20.00mL待测醋酸,并加入2-3滴指示剂.
(1)用离子方程式表示该实验的原理CH3COOH+OH-=CH3COO-+H2O.
(2)从上述实验步骤中选出正确的并按操作先后排序.你的实验顺序为:(用字母表示)G→D→A→F→B→H→C.
(3)实验室常用的酸碱指示剂有甲基橙、石蕊和酚酞,你选择的指示剂是酚酞,理由是两者恰好完全中和生成醋酸钠,其水溶液呈碱性,必需选择在碱性范围变色且颜色容易判断的酚酞作指示剂判断滴定终点;滴定终点的现象是无色溶液变浅红色且半分钟内不褪色.
(4)某同学实验后得到的数据如表:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH)/mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH)/mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
(5)分析下列操作对测定结果的影响,用“偏低”、“偏高”或“不影响”填空.
①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡偏低;
②读取标准溶液体积时,滴定前平视,滴定后仰视偏高.
18.下列有关叙述正确的是( )
| A. | 氢键是一种特殊化学键,它广泛地存在于自然界中 | |
| B. | 在 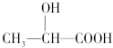 分子中含有1个手性C原子 分子中含有1个手性C原子 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大 |
15.下列电子式中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
2.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
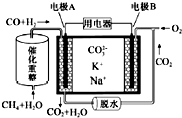

| A. | 电极B为正极,CO2在正极发生还原反应 | |
| B. | 电极A上H2参与的电极反应为:H2+CO32--2e-=CO2↑+H2O | |
| C. | 电极B上发生的电极反应为:4H++O2+4e-=2H2O | |
| D. | 电池工作时,CO32-向电极B移动 |
12.下列有关实验操作设计、现象记录、结论解释都正确的是( )
| 选项 | 实验操作设计 | 现象记录 | 结论解释 |
| A |  打开分液漏斗 | 右侧试管中出现白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| B | 向稀硝酸和稀硫酸中分别加入铁粉 | 均有气泡冒出 | 两者均发生氧化还原反应 |
| C | 将SO2通入Ba(NO3)3溶液中 | 有白色沉淀生成 | 白色沉淀是BaSO3 |
| D | 向盛有Fe(NO3)3溶液的试管中加入0.1mol•LH2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+ 还原为NO2 |
| A. | A | B. | B | C. | C | D. | D |
19.下列反应的能量变化与其他三项不相同的是( )
| A. | 铝粉与氧化铁的反应 | B. | 炽热的炭与二氧化碳的反应 | ||
| C. | 锌片与稀硫酸反应 | D. | 氢氧化钠与盐酸反应 |
17.下列关于炔烃的说法不正确的是( )
| A. | 分子里含有碳碳三键的脂肪烃 | |
| B. | 易发生加成反应 | |
| C. | 既能使溴水褪色也能使酸性高锰酸钾溶液褪色 | |
| D. | 分子里所有的碳原子都处在同一条直线上 |