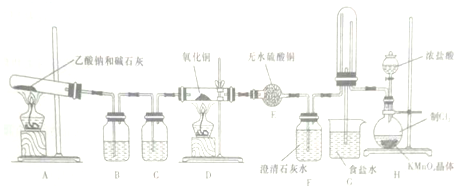
题目内容
15.下列叙述正确的是( )| A. | 常温下,0.1 mol•L-1 pH=8的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| B. | pH=12氨水溶液与pH=2盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 相同物质的量浓度的下列溶液中:①NH4Al(SO4)2②NH4Cl③CH3COONH4④c(NH3•H2O);c(NH4+)由大到小的顺序是:①>②>③>④ | |
| D. | 某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-?H++A2-则在NaHA溶液中:c(Na+)=c(HA-)+c(A2-)+c(H2A) |
分析 A.常温下,0.1 mol•L-1 pH=8的NaHB溶液显碱性,说明HB-离子水解程度大于其电离程度,据此分析离子浓度大小;
B.pH=12氨水溶液与pH=2盐酸溶液等体积混合,一水合氨是弱碱存在电离平衡,一水合氨又电离出氢氧根离子和铵根离子;
C.NH4Al(SO4)2溶液中铵根离子与铝离子水解相互抑制,CH3COONH4中铵根离子与醋酸根离子水解相互促进;
D.某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-?H++A2-,第一步电离完全电离,HA-离子不水解;
解答 解:A.常温下,0.1 mol•L-1 pH=8的NaHB溶液显碱性,说明HB-离子水解程度大于其电离程度,溶液中离子浓度大小,c(HB-)>c(H2B)>c(B2-),故A错误;
B.pH=12氨水溶液与pH=2盐酸溶液等体积混合,一水合氨是弱碱存在电离平衡,一水合氨又电离出氢氧根离子和铵根离子,c(NH4+)>c(Cl-)>c(OH-)>c(H+),故B错误;
C.NH4Al(SO4)2溶液中铵根离子与铝离子水解相互抑制,CH3COONH4中铵根离子与醋酸根离子水解相互促进,一水合氨是弱电解质存在电离平衡,铵根离子浓度最小,所以,相同物质的量浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④c(NH3•H2O),则c(NH4+)由大到小的顺序是:①>②>③>④,故C正确;
D.某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-?H++A2-,第一步完全电离,HA-离子不水解,在NaHA溶液中据物料守恒存在c(Na+)=c(A2-)+c(HA-),故D错误;
故选C.
点评 本题考查弱电解质的电离平衡,涉及离子浓度大小比较,做题中注意利用电荷守恒、物料守恒解答此类题目,题目难度中等.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | 往CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O=CaCO3↓+2H+ | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 向澄清石灰水中滴加少量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A. | 从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂 | |
| B. | 25min时平衡正向移动但达到新平衡后 NH3的体积分数比原平衡大 | |
| C. | 反应开始到第一次平衡时,N2的平均反应速率为0.0625mol•(L•min)-1,H2的转化率为75% | |
| D. | 从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动 |
①NaHCO3溶液 ②浓硫酸 ③NaOH溶液 ④碳.
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
| A. | 室温时,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) | |
| B. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 0.1 mol•L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| D. | 0.1 mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NaCl是离子化合物 | NaCl固体可导电 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | 1-己醇的沸点比己烷的沸点高89℃ | 1-己醇和己烷可通过蒸馏初步分离 |
| D | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
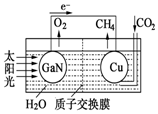 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.