题目内容
16.NA表示阿伏加德罗常数,下列说法中正确的是( )| A. | 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA | |
| B. | 1 mol-CH3和1 mol OH-都含有10 NA个电子 | |
| C. | 标准状况下3.36 L CCl4含碳原子数为0.15NA | |
| D. | 1mol Na完全反应生成Na2O2时失去NA个电子 |
分析 A、Fe3+是弱碱阳离子,在溶液中会水解;
B、-CH3中含9个电子;
C、标况下四氯化碳为液体;
D、根据反应后钠元素为+1价来分析.
解答 解:A、Fe3+是弱碱阳离子,在溶液中会水解,故溶液中的Fe3+和SO42-离子数的总和小于NA,故A错误;
B、-CH3中含9个电子,故1mol甲基中含9mol电子即9NA个,故B错误;
C、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、由于反应后钠元素为+1价,故1mol钠失去1mol即NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
6.关于下列各图的叙述中正确的是( )


| A. | 甲可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I)的变化 | |
| B. | 乙可表示在恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释pH相同的HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则HA的酸性比HB的酸性强 |
7.蒸干灼烧下列物质的水溶液,能得到该物质的是( )
| A. | AlC13 | B. | Fe2(SO4)3 | C. | NaHCO3 | D. | (NH4)2CO3 |
4.下列有关说法正确的是( )
| A. | 将CO2气体通入到CaCl2溶液可生成CaCO3沉淀 | |
| B. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 | |
| C. | 向氢氧化铁胶体中加入过量的稀硫酸,会观察到先产生红褐色沉淀后沉淀又溶解 | |
| D. | 碳酸氢钠的电离方程式为:NaHCO3═Na++H++CO3- |
11.在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g•cm-3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L.下列叙述中正确的是( )
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | C=$\frac{1000a}{22.4V}$mol/L | |
| C. | 可用装置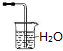 吸收氨气 吸收氨气 | |
| D. | 上述溶液中再加入VmL水,所得溶液的质量分数大于0.5ω |
1.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时,X和W可形成化合物,该化合物0.1mol/L的水溶液pH为1,下列说法正确的是( )
| A. | Z、R、W形成的单核离子核外电子数相等 | |
| B. | R元素的最高价氧化物的水化物酸性最强 | |
| C. | 原子半径:X<Y<Z<R<W | |
| D. | X、Z分别与Y可形成原子个数比为1:1或2:1的化合物 |
5.在Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2反应中,Fe2O3( )
| A. | 所含铁元素化合价降低,被氧化 | |
| B. | 160gFe2O3失去6mol电子 | |
| C. | Fe2O3→Fe的过程需要加还原剂才能实现 | |
| D. | 是还原产物 |
6.用NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 2.7g铝与足量的NaOH溶液反应转移的电子数目为0.2NA | |
| B. | 1L0.5mol/L的(NH4)2SO4溶液中含有的NH4+数目为NA | |
| C. | 2mol SO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| D. | 2.24L N2和NH3混合气体中原子间含有的共用电子对数目为0.3NA |
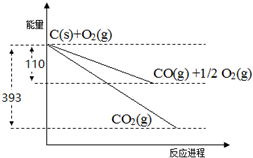 完成下列方程式
完成下列方程式