题目内容
14.在C6H14的各种同分异构体中,所含甲基数目和它的-氯取代物的数目与下列叙述相符的是( )| A. | 2个甲基,能生成4种-氯代物 | B. | 3个甲基,能生成5种-氯代物 | ||
| C. | 3个甲基,能生成9种-氯代物 | D. | 4个甲基,能生成4种-氯代物 |
分析 C6H14属于烷烃,根据甲基数目写出符合条件的同分异构体的结构简式,利用等效氢判断其一氯代物的数目.
解答 解:A.含2个甲基,为CH3CH2CH2CH2CH2CH3,有3种H原子,则有3种一氯代物,故A错误;
B.含3个甲基,有 和
和 两种结构,前一种结构有5种一氯代物,后一种结构,有4种一氯代物,故B错误;
两种结构,前一种结构有5种一氯代物,后一种结构,有4种一氯代物,故B错误;
C.含3个甲基,有 和
和 两种结构,前一种结构有5种一氯代物,后一种结构,有4种一氯代物,故C正确;
两种结构,前一种结构有5种一氯代物,后一种结构,有4种一氯代物,故C正确;
D.含4个甲基,则有 和
和 两种结构,前一种有2种一氯代物,后一种有3种一氯代物,故D错误;
两种结构,前一种有2种一氯代物,后一种有3种一氯代物,故D错误;
故选C.
点评 本题考查同分异构体的书写,难度不大,根据甲基数目书写符合条件的同分异构体结构是关键.

练习册系列答案
相关题目
2.一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O2?2SO3,其起始物质的量及SO2的平衡转化率如下表所示.下列判断中正确的是( )
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率/% | 80 | a1 | a2 | a3 | |
| A. | 该温度下,该反应的平衡常数K为400 | |
| B. | SO2的平衡转化率:a1>a2=a3 | |
| C. | 达到平衡时,容器丁中的正反应速率比容器丙中的大 | |
| D. | 达到平衡时,容器丙中c( SO3)大于容器甲中c( SO3)的两倍 |
19.25℃时,下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 0.1mol•L-1NaHS溶液:c(OH-)+c(S2-)═c(H+)+c(H2S) | |
| C. | 0.1mol•L-1CH3COOH溶液和0.1mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
6.分子式为C4H7ClO2的同分异构体甚多,其中能与NaHCO3溶液发生反应产生CO2的同分异构体共有(不考虑立体异构)( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
3.下列物质中含有离子的是( )
| A. | 晶体硅 | B. | 冰醋酸 | C. | 液态氯化氢 | D. | 氧化铝 |
4.下列离子方程式与所述事实相符且正确的是( )
| A. | 用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I-═I2+2OH- | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 工业电解熔融氯化钠制金属钠:2Na++2Cl-$?_{熔融}^{电解}$2Na+Cl2↑ | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
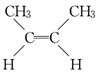 、
、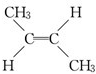 .
.