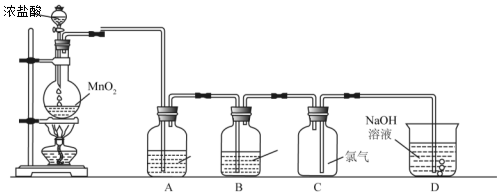
题目内容
9.将70g过氧化钠和氧化钠的混合物跟98g水充分反应,所得气体在标准状况下为5.6L,试分别写出过氧化钠和氧化钠跟水反应的化学方程式,并计算所得溶液质量分数为多少?分析 溶于水发生Na2O+H2O=2NaOH、2Na2O2+2H2O=4NaOH+O2↑,n(O2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,反应后溶液的溶质为NaOH,结合反应计算.
解答 解:过氧化钠和氧化钠跟水反应的化学方程式分别为Na2O+H2O=2NaOH、2Na2O2+2H2O=4NaOH+O2↑,
n(O2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,则
2Na2O2+2H2O=4NaOH+O2↑
0.5 1 0.25
n(Na2O)=$\frac{70g-0.5mol×78g/mol}{62g/mol}$=0.5mol,
Na2O+H2O=2NaOH
0.5 1
可知反应后溶质NaOH为1mol+1mol=2mol,
所得溶液质量分数为$\frac{2mol×40g/mol}{70g+98g-0.25mol×32g/mol}$×100%=50%,
答:反应为Na2O+H2O=2NaOH、2Na2O2+2H2O=4NaOH+O2↑,所得溶液质量分数为50%.
点评 本题考查化学反应的计算,为高频考点,把握发生的反应、反应中物质的量关系为解答的关键,侧重分析与计算能力的考查,注意质量守恒的应用,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案
相关题目
14.在C6H14的各种同分异构体中,所含甲基数目和它的-氯取代物的数目与下列叙述相符的是( )
| A. | 2个甲基,能生成4种-氯代物 | B. | 3个甲基,能生成5种-氯代物 | ||
| C. | 3个甲基,能生成9种-氯代物 | D. | 4个甲基,能生成4种-氯代物 |
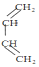 +
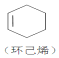
+ →
→
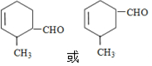 .
.
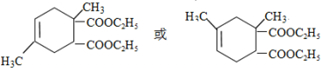 .
.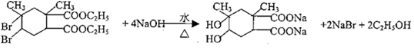 .
.