题目内容
4.在标准状况下,将224LHCl气体溶于635mL水(ρ=1.00g/cm3)中,所得盐酸的密度为1.18g/cm3. 试计算:(1)取出这种盐酸10mL,稀释至1.45L,所得稀盐酸的物质的量浓度.
(2)在40.0mL0.065mol/L Na2CO3 溶液中,逐滴加入(1)中所配制的稀盐酸,边滴加边振荡.若使反应不产生 CO2气体,加入稀盐酸的体积最多不能超过多少毫升?
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算HCl物质的量,根据m=nM计算HCl质量,根据m=ρV计算水的质量,进而计算溶液质量分数,根据c=$\frac{1000ρω}{M}$计算溶液物质的量浓度;然后根据稀释定律c(浓)•V(浓)=c(稀)•V(稀)计算所得稀盐酸的物质的量浓度;
(2)使反应不产生CO2气体,发生反应:Na2CO3+HCl═NaHCO3+NaCl,根据方程式计算消耗HCl的物质的量,进而计算需要盐酸的体积.
解答 解:(1)n(HCl)=$\frac{224L}{22.4L/mol}$=10mol,m(HCl)=10mol×36.5g•mol-1=365g,
635mL水的质量为635mL×1g/mL=635g,
盐酸的质量分数w=$\frac{365g}{365g+635g}$×100%=36.5%,
c(HCl)=$\frac{1000ρω}{M}$=$\frac{1000×1.18×36.5%}{36.5}$mol/L=11.8mol/L,
根据c(浓)•V(浓)=c(稀)•V(稀)
可知:c(稀)=11.8mol•L-1×0.01L÷1.45L=0.0814 mol/L,
答:所得稀盐酸的物质的量浓度为0.0814 mol/L;
(2)n(Na2CO3)=0.040L×0.065mol•L-1=0.0026 mol,使反应不产生CO2气体,发生反应:Na2CO3+HCl═NaHCO3+NaCl,根据方程式可知消耗HCl为0.0026mol,
设加入稀盐酸的体积最多不超过x mL,则n(HCl)=0.0814 mol/L×0.001x L=8.14×10-5x mol,
根据反应Na2CO3+HCl═NaHCO3+NaCl,可得0.0026=8.14×10-5x,解得x=31.9,
答:加入稀盐酸的体积最多不超过31.9毫升.
点评 本题考查物质的量浓度计算、化学方程式的有关计算,侧重于学生的分析、计算能力的考查,注意对公式的理解与灵活应用,理解掌握物质的量浓度与质量分数之间的关系,难度不大.

| A. |  制备氢氧化亚铁 | B. | 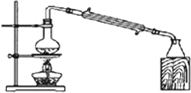 石油的分馏 | ||
| C. | 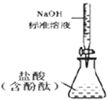 测定盐酸浓度 | D. | 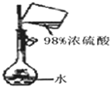 配制稀硫酸 |
| A. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| B. | 用托盘天平称取 25.20 g NaCl晶体 | |
| C. | 用广范 pH试纸测得某碱溶液的pH为12.7 | |
| D. | 用25 mL 碱式滴定管量取14.80 mL NaOH 溶液 |
| A. | 4g氢氧化钠溶于水,电离出的离子总数为2NA | |
| B. | 35.5g氯气中所含的原子数为2NA | |
| C. | 0.1mol钠变成钠离子时,失去的电子数目0.1NA | |
| D. | 实验室制氯气,得到2.24L(标准状况下)氯气时电子转移数0.1NA |
 近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示).苯属于( )
近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示).苯属于( )| A. | 酸 | B. | 混合物 | C. | 无机物 | D. | 有机物 |
| 元素 | A | B | C | D |
| 相关的原子结构与性质 | 元素符号为At,与稀有气体元素相邻,但半径比I大 | 其在周期表的周期数和族序数比K的均大1 | 元素符号为Tl,名称是铊,原子核外有六个电子层,与Al同主族 | 可形成双原子分子,分子内有叁键 |
| A. | 元素A的单质可能是一种有色的固体物质,其氢化物HAt易溶于水,很稳定 | |
| B. | 常温下B的单质能与冷水发生剧烈反应,其硫酸盐可能易溶于水 | |
| C. | 铊氧化物化学式为Tl2O3,是离子化合物,Tl2O3和Tl(OH)3均是两性的物质 | |
| D. | 元素D的一些氧化物在大气中会产生光化学烟雾,还会破坏臭氧层 |
| A. | 水与冰 | B. | O2与O3 | C. |  与 与  | D. |  与 与 |
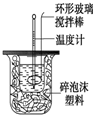 利用右图装置测定中和热的实验步骤如下:
利用右图装置测定中和热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,并测出其温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式(中和热数值为57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)倒入NaOH溶液的正确操作是C.
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)实验数据如表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
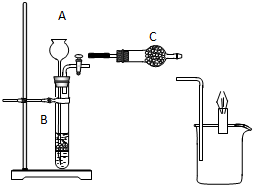 如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答:
如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答: