题目内容
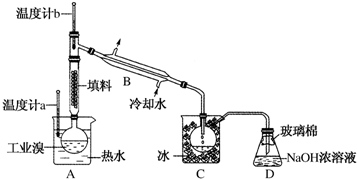
14. 利用右图装置测定中和热的实验步骤如下:
利用右图装置测定中和热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,并测出其温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式(中和热数值为57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)倒入NaOH溶液的正确操作是C.
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)实验数据如表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
分析 (1)根据酸碱中和热书写热化学方程式;
(2)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果;
(3)先判断温度差的有效性,然后求出温度差平均值,再根据Q=m•c•△T计算反应放出的热量,最后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热.
解答 解:(1)中和热数值为57.3kJ/mol,反应放热,则中和热的热化学方程式:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
故答案为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故答案为:C;
(3)3次温度差分别为:3.4℃,3.3℃,3.5℃,3组数据均有效,温度差平均值3.4℃,50mL 0.25mol/L硫酸与50mL 0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-$\frac{1.4212kJ}{0.025mol}$=-56.8kJ/mol;
故答案为:3.4℃;-56.8kJ/mol.
点评 本题主要考查热化学方程式以及反应热的计算,题目难度中等,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.

 阅读快车系列答案
阅读快车系列答案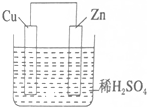 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极有H2产生;
⑤若有1mol电子流过导线,则产生H2为0.5mol;
⑥正极的电极反应式为Zn-2e-=Zn2+;
⑦Cu电极上发生氧化反应
⑧电流由Cu外电路流向Zn.
| A. | ①②③⑦ | B. | ②③④⑧ | C. | ③④⑤⑧ | D. | ④⑤⑥⑦ |
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是cd
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是B
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/KW D.c(H+)/c(OH-)
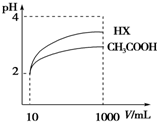
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
| A. | 12.5% | B. | 25% | C. | <25% | D. | >25% |
| A. | 甲烷分子的比例模型: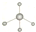 | B. | 苯的最简式:CH | ||
| C. | 乙烯的分子式:CH2=CH2 | D. | 乙醇的结构简式:C2H6O |