题目内容
16.有A、B、C、D主族元素,有关它们的一些信息如表所示:| 元素 | A | B | C | D |
| 相关的原子结构与性质 | 元素符号为At,与稀有气体元素相邻,但半径比I大 | 其在周期表的周期数和族序数比K的均大1 | 元素符号为Tl,名称是铊,原子核外有六个电子层,与Al同主族 | 可形成双原子分子,分子内有叁键 |
| A. | 元素A的单质可能是一种有色的固体物质,其氢化物HAt易溶于水,很稳定 | |
| B. | 常温下B的单质能与冷水发生剧烈反应,其硫酸盐可能易溶于水 | |
| C. | 铊氧化物化学式为Tl2O3,是离子化合物,Tl2O3和Tl(OH)3均是两性的物质 | |
| D. | 元素D的一些氧化物在大气中会产生光化学烟雾,还会破坏臭氧层 |
分析 A.卤族元素从上到下,单质的颜色逐渐加深,氢化物稳定性减弱;
B.B在周期表的周期数和族序数比K的均大1,则为第五周期第ⅡA族元素,根据递变性规律分析;
C、铊为较活泼金属,Tl2O3和Tl(OH)3均不属于两性物质;
D、D为N,氮的部分氧化物会产生光化学烟雾,还会破坏臭氧层.
解答 解:A.卤族元素从上到下,单质的颜色逐渐加深,由于碘单质为紫黑色固体,故At的单质为有色固体,同主族从上到下氢化物稳定性减弱,HAt,很不稳定,故A错误;
B.B在周期表的周期数和族序数比K的均大1,则为第五周期第ⅡA族元素,由于硫酸钙为微溶,从上到下溶解度减小,故B对于的硫酸盐在水中不会是易溶,故B错误;
C、铊为较活泼金属,Tl2O3和Tl(OH)3均不属于两性物质,Tl(OH)3为强碱,故C错误;
D、D为N,氮的部分氧化物会产生光化学烟雾,还会破坏臭氧层,故D正确;
故选D.
点评 本题考查元素周期表与元素周期律,推断元素是解题的关键,注意理解同主族元素相似性与递变性规律,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.某混合气体由两种气态烃组成,2.24L该混合气体完全燃烧后,得到4.48L二氧化碳(气体体积已折算为标准状况时的体积)和3.6g水,则两种气态烃可能是( )
| A. | CH4和C3H8 | B. | C2H4和C2H6 | C. | CH4和C3H4 | D. | C2H4和C3H4 |
7.下列反应中,水既不做氧化剂、又不做还原剂的氧化还原反应是( )
| A. | 钠和水反应 | B. | 过氧化钠和水反应 | ||
| C. | 氧化钠和水反应 | D. | 二氧化碳和水 |
11.下列说法或表示方法正确的是( )
| A. | 反应物的总能量低于生成物的总能量时,该反应一定不能发生 | |
| B. | 强酸跟强碱反应放出的热量一定是中和热 | |
| C. | 由反应C(金刚石,s)═C(石墨,s)△H<0,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
1.已知氢化铵(NH4H)与NH4Cl的结构相似,又知NH4H与水反应有H2生成,下列有关叙述中不正确的是( )
①NH4H是离子化合物,含有离子键和共价键
②NH4H溶于水,所形成的溶液显酸性
③NH4H与水反应时,NH4H是氧化剂
④NH4H固体投入少量水中,有两种气体产生.
①NH4H是离子化合物,含有离子键和共价键
②NH4H溶于水,所形成的溶液显酸性
③NH4H与水反应时,NH4H是氧化剂
④NH4H固体投入少量水中,有两种气体产生.
| A. | ①② | B. | ②③ | C. | ①②③ | D. | 全部 |
8.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,下列说法正确的是( )
| A. | 原子半径:A<B<C<D<E | |
| B. | D单质能够溶解于C的最高价氧化物对应的水化物 | |
| C. | 金属性:D>C | |
| D. | 化合物AE与CE含有相同类型的化学键 |
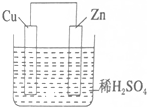 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )