题目内容
19.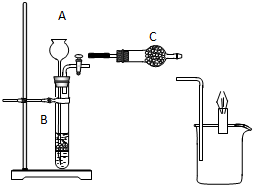 如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答:
如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答:(1)仪器A、C中盛放的物质名称是
A盐酸
C过氧化钠
(2)写出B中反应的离子方程式CaCO3+2H+=Ca2++CO2↑+H2O
(3)写出C中反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
分析 B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,说明B中上火车气体与C中物质反应生成氧气,则C应为过氧化钠,A中所加入液体可为盐酸等,以此解答该题.
解答 解:B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,说明B中上火车气体与C中物质反应生成氧气,则C应为过氧化钠,A中所加入液体可为盐酸等,
(1)由以上分析可知A中盛放物质为盐酸,C中盛放物质为过氧化钠,故答案为:盐酸;过氧化钠;
(2)盐酸与碳酸钙反应生成氯化钙、水和二氧化碳气体,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(3)过氧化钠和二氧化碳反应碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查二氧化碳的制备以及过氧化钠的性质,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质,难度不大.

练习册系列答案
相关题目
9.以下是电化学原理的应用问题.
(1)由A、B、C、D四种金属按下表装置图进行实验.
根据实验现象回答问题:四种金属活动性由强到弱的顺序是D>A>B>C.
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图1为电池示意图,请回答:
①氢氧燃料电池的能量转化的主要形式是由化学能转变为电能,在导线中电子流动方向为由a到b(用a、b表示).
②负极反应式为2H2+4OH--4e-=4H2O(或H2+2OH--2e-=2H2O).
(3)如图2中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体.回答:
①直流电源中,M为正极.
②AgNO3溶液的浓度(填“增大”“减小”或“不变”.下同)不变,H2SO4溶液的浓度增大.
③此时电路中转移电子的物质的量为0.02mol.
(1)由A、B、C、D四种金属按下表装置图进行实验.
| 装置 |  | 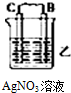 | 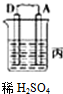 |
| 现象 | 金属A不断溶解 | C极质量增加 | A上有气体产生 |
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图1为电池示意图,请回答:

①氢氧燃料电池的能量转化的主要形式是由化学能转变为电能,在导线中电子流动方向为由a到b(用a、b表示).
②负极反应式为2H2+4OH--4e-=4H2O(或H2+2OH--2e-=2H2O).
(3)如图2中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体.回答:
①直流电源中,M为正极.
②AgNO3溶液的浓度(填“增大”“减小”或“不变”.下同)不变,H2SO4溶液的浓度增大.
③此时电路中转移电子的物质的量为0.02mol.
10.下列物质中,既能跟盐酸反应,又能跟氢氧化钠溶液反应的是( )
| A. | NH4NO3 | B. | AlCl3 | C. | Na2CO3 | D. | Al2O3 |
7.下列反应中,水既不做氧化剂、又不做还原剂的氧化还原反应是( )
| A. | 钠和水反应 | B. | 过氧化钠和水反应 | ||
| C. | 氧化钠和水反应 | D. | 二氧化碳和水 |
14.下列溶液中氯离子的物质的量浓度最大的是( )
| A. | 65 mL 2mol/L的NaCl溶液 | B. | 25 mL 2mol/L的MgCl2溶液 | ||
| C. | 10 mL 2mol/L的AlCl3溶液 | D. | 50 mL 2mol/L的kCl溶液 |
11.下列说法或表示方法正确的是( )
| A. | 反应物的总能量低于生成物的总能量时,该反应一定不能发生 | |
| B. | 强酸跟强碱反应放出的热量一定是中和热 | |
| C. | 由反应C(金刚石,s)═C(石墨,s)△H<0,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
8.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,下列说法正确的是( )
| A. | 原子半径:A<B<C<D<E | |
| B. | D单质能够溶解于C的最高价氧化物对应的水化物 | |
| C. | 金属性:D>C | |
| D. | 化合物AE与CE含有相同类型的化学键 |
9. 25℃时,电离平衡常数:
25℃时,电离平衡常数:
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是cd
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是B
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/KW D.c(H+)/c(OH-)
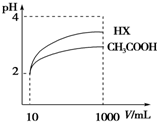
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是cd
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是B
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/KW D.c(H+)/c(OH-)
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)