题目内容
19.用Cl2生产某些含氯有机物时会产生副产物HC1.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$?_{400℃}^{CuO、CuCl_{2}}$2Cl2+2H2O
已知:ⅰ.反应A中,4mol HCl被氧化,放出115.6kJ的热量.
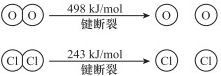
ⅱ.
(1)H2O的电子式是
 .
.(2)断开1mol H-O 键与断开 1mol H-Cl 键所需能量相差约为32kJ,H2O中H-O 键比HCl中H-Cl键(填“强”或“弱”)强.
分析 (1)共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况;
(2)反应热△H=反应物总键能-生成物的总键能,据此计算H-O键与H-Cl键的键能差,进而计算断开1mol H-O键与断开1mol H-Cl键所需能量差.
解答 解:(1)H2O是共价化合物,是由原子和氢原子形成共价键,电子式为 ,故答案为:
,故答案为: ;
;
(2)E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,
故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ≈32kJ,所以H2O中H-O 键比HCl中H-Cl键强;
故答案为:32;强.
点评 本题考查了焓变等于反应物的键能和减去生成物的键能和、电子式的书写,题目难度中等.

练习册系列答案
相关题目
13.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | 235U中的235表示该原子的相对原子质量 | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 丙烷分子的比例模型: | |
| D. | 第三周期简单阴离子结构示意图均可表示为 |
14.下列化学用语正确的是( )
| A. | 乙烯的实验式:C2H4 | B. | 四氯化碳分子的电子式为: | ||
| C. | 聚丙烯的结构简式为: | D. | 异丁烷分子的键线式为: |
4.下列各组物质的晶体中,化学键类型和晶体类型均相同的是( )
| A. | NH3和NH4Cl | B. | HCl和SiO2 | C. | CO2和H2O | D. | KCl和K |
11.CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用分别是( )
| A. | 分子间作用力,离子键 | B. | 化学键,分子间作用力 | ||
| C. | 化学键,化学键 | D. | 分子间作用力,分子间作用力 |
8.有如下合成路线,甲经二步转化为丙:

下列叙述正确的是( )

下列叙述正确的是( )
| A. | 反应(1)的无机试剂是液溴,铁作催化剂 | |
| B. | 步骤(2)产物中可能含有未反应的甲,可用酸性高锰酸钾溶液检验是否含甲 | |
| C. | 乙既能发生水解反应,又能发生消去反应 | |
| D. | 反应(1)和(2)均为取代反应 |
9.下列关于化学用语的表示正确的是( )
| A. | 过氧化钠的电子式: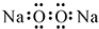 | |
| B. | 乙醇的分子式:C2H5OH | |
| C. | 硫离子的结构示意图: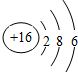 | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |