题目内容
4.将4molA气体和2molB气体在2L固定体积的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)═2C(g).若经2s后测得C的物质的量为1.2mol,现有下列几种说法,其中正确的是( )| A. | 用物质A表示的反应的平均速率为0.6mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为0.6mol•L-1•s-1 | |
| C. | 2s时物质A的转化率为70% | |
| D. | 2s时物质B的物质的量为 1.4mol |
分析 将 4mol A 气体和 2mol B 气体在 2L 的密闭容器中混合并在一定条件下发生如下反应 2A(g)+B(g)?2C(g),若经 2s(秒)后测得C的物质的量为1.2mol,依据化学平衡三段式列式计算:
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s末(mol) 2.8 1.4 1.2
结合v=$\frac{△c}{△t}$、c=$\frac{n}{V}$计算相关物理量,以此解答该题.
解答 解:将 4mol A 气体和 2mol B 气体在 2L 的密闭容器中混合并在一定条件下发生如下反应 2A(g)+B(g)?2C(g),若经 2s(秒)后测得C的物质的量为1.2mol,依据化学平衡三段式列式计算:
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s末(mol) 2.8 1.4 1.2
A.用物质A表示的反应的平均速率为$\frac{\frac{1.2mol}{2L}}{2s}$=0.3mol•L-1•s-1,故A错误;
B.用物质B表示的反应的平均速率为$\frac{\frac{0.6mol}{2L}}{2s}$=0.15mol•L-1•s-1,故B错误;
C.2s时物质A的转化率为$\frac{1.2}{4}×100%$=30%,故C错误;
D.由以上分析可知2s时物质B的物质的量为 1.4mol,故D正确.
故选D.
点评 本题考查化学平衡与化学反应速率的有关计算,为高频考点,难度不大,侧重对基础知识的巩固,注意反应速率的计算通常有定义法、化学计量数法.

 通城学典默写能手系列答案
通城学典默写能手系列答案| A. | 在pH=1的溶液中:SO32-、Cl-、NO3-、Na+ | |
| B. | 在能使酚酞变红的溶液中:Na+、Cl-、NO3-、K+ | |
| C. | 在1 mol•L-1的NaAlO2溶液中:K+、Ba2+、SO42-、OH- | |
| D. | 在1 mol•L-1的AlCl3溶液中:NH4+、Ag+、Na+、NO3- |
| A. | 2min内,用NO表示的该反应的平均速度v(NO)=0.03mol•L-1•min-1 | |
| B. | 容器内混合气体密度保持不变可以说明反应达到平衡状态 | |
| C. | T℃时,该反应的平衡常数K=$\frac{9}{32}$ | |
| D. | 升高温度,可以提高反应速率和NO的转化率 |
 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
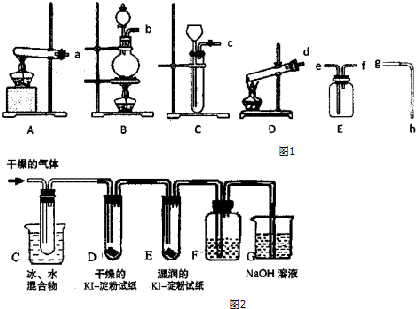
在干燥的50mL圆底烧瓶中,装入沸石,加入12.0mL正丁醇和16.0mL冰醋酸(过量),再加3~4滴浓硫酸.然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热.将烧瓶中反应后的混合物冷却与分水器的酯层合并.装置中冷水应从b(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是分离生成的水,使平衡正向移动,提高反应产率.
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤.
①正确的操作步骤是C(填标号).
A.①②③④B.③①④②C.④①③②D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是除去产品中含有的乙酸、硫酸等杂质.
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为77.1%.
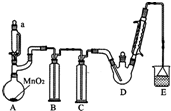 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是饱和食盐水,若撤去装置B,可能导致装置D中副产物C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)装置中球形冷凝管的作用为冷凝回流,写出E中所有可能发生的无机反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行不可行.
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1Na2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为66.4%(计算结果保留三位有效数字).
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是abc.
a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大.
| A. | 燃料的脱硫脱氮、NO的催化转化都是减少酸雨产生的措施 | |
| B. | 利用稀硝酸清除铜镜表面的铜锈是因为稀硝酸具有强氧化性 | |
| C. | BaSO4难溶于水和强酸,在医学上常用作钡餐 | |
| D. | 食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质 |