题目内容
14.下列性质的递变规律不正确的是( )| A. | NaOH、KOH、CsOH碱性依次增强 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | Al3+、Mg2+、Na+的离子半径依次减小 | |
| D. | O22-和S2-具有相同的质子数和电子数 |
分析 A.同一主族中原子序数越大,金属性越强,最高价氧化物对应水合物的碱性越强;
B.同一主族的元素,原子序数越大,金属性越强,失去电子的能力逐渐增强;
C.三种离子的电子层相同,核电荷数越大,离子半径越小;
D.O22-和S2-的质子数、电子数都分别为16、18.
解答 解:A.Na、K、Cs位于同一主族,原子序数逐渐增大,则金属性Na<K<Cs,则最高价氧化物对应水合物NaOH、KOH、CsOH的碱性依次增强,故A正确;
B.Li、Na、K、Rb、Cs位于同一主族,原子序数逐渐增大,金属性逐渐增强,则失电子能力逐渐增强,故B正确;
C.Al3+、Mg2+、Na+都含有2个电子层,核电荷数Al>Mg>Na,核电荷数越大,离子半径越小,则离子半径依次增大,故C错误;
D.O22-含有16个质子、18个电子,S2-也含有16个质子、18个电子,二者含有的质子数、电子数相同,故D正确;
故选C.
点评 本题考查了元素周期律的应用,题目难度不大,明确原子结构与元素周期律的关系为解答关键,注意掌握比较离子半径大小的方法,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
9.短周期元素A、B、C、D、E 的原子序数依次递增,A原子最外层电子数是次外层电子数的2 倍,C 的氢化物在常温下为液体,C 和D 的化合物可以制造高性能通讯材料,E 元素的最高化合价和最低化合价的代数和为6.下列叙述错误的是( )
| A. | E 元素处于元素周期表中第3 周期第ⅦA 族 | |
| B. | 元素A、B、C 的原子半径:C>B>A | |
| C. | 元素B、C、D 的非金属性:C>B>D | |
| D. | 一定条件下,A 单质可以将D 单质从其氧化物中置换出来 |
19.芳香烃是指( )
| A. | 分子中有一个或多个苯环的化合物 | |
| B. | 分子组成满足通式CnH2n-6(n≥6)的化合物 | |
| C. | 分子中含有苯环的烃 | |
| D. | 苯及苯的同系物的总称 |
6.已知某有机物分子中H原子个数为偶数,若将2.25克该有机物在足量氧气中完全燃烧,得到4.4克CO2和2.25克的H2O,则下列说法不正确的是( )
| A. | 可以确定该有机物的相对分子量为90 | |
| B. | 可以确定该有机物的分子式为C4H10O2 | |
| C. | 该有机物中碳、氢、原子个数比为2:5:1 | |
| D. | 因为不知道其相对分子量,故无法确定其分子式 |
3.现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)B为Ba(OH)2溶液,C为HCl 溶液(填化学式)
(2)写出A溶液与E溶液反应的化学方程式:3Na2CO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CO2↑+3Na2SO4.
(3)写出E溶液与过量的B溶液反应的离子方程式:2A13++3SO42-+3Ba2++8OH-=2A1O2-+3BaSO4↓+4H2O.
(4)已知:NaOH(aq)+HNO3(aq)=NaNO3 (aq)+H2O(1)△H=-akJ•mol-1.请写出B与C的稀溶液反
应的热化学方程式OH-(aq)+H+(aq)=H2O(1)△H=-a kJ/mol或1/2Ba(OH)2(aq)+HC1(aq)=1/2BaC12(aq)+H2O(1)△H=-a kJ/mol或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2akJ/mol.
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)B为Ba(OH)2溶液,C为HCl 溶液(填化学式)
(2)写出A溶液与E溶液反应的化学方程式:3Na2CO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CO2↑+3Na2SO4.
(3)写出E溶液与过量的B溶液反应的离子方程式:2A13++3SO42-+3Ba2++8OH-=2A1O2-+3BaSO4↓+4H2O.
(4)已知:NaOH(aq)+HNO3(aq)=NaNO3 (aq)+H2O(1)△H=-akJ•mol-1.请写出B与C的稀溶液反
应的热化学方程式OH-(aq)+H+(aq)=H2O(1)△H=-a kJ/mol或1/2Ba(OH)2(aq)+HC1(aq)=1/2BaC12(aq)+H2O(1)△H=-a kJ/mol或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2akJ/mol.
4.实验中发生如下事故,处理方法不正确的是( )
| A. | 浓H2SO4溅到皮肤上,立即涂3%~5%的NaHCO3溶液,再用大量水冲洗 | |
| B. | 温度计打破,水银洒在桌上,立即用硫粉覆盖 | |
| C. | 在实验中不慎手被玻璃划破,可用碘酒或双氧水清洗后,再用药外敷 | |
| D. | 不慎将酸溅到眼中,应立即用水清洗,边洗边眨眼 |
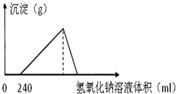 将5.1g的氧化铝溶于一定浓度的500mL的盐酸中,充分反应后,再逐滴加入0.5mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算:
将5.1g的氧化铝溶于一定浓度的500mL的盐酸中,充分反应后,再逐滴加入0.5mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算: