题目内容
3.现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各种离子不重复).| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)B为Ba(OH)2溶液,C为HCl 溶液(填化学式)
(2)写出A溶液与E溶液反应的化学方程式:3Na2CO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CO2↑+3Na2SO4.
(3)写出E溶液与过量的B溶液反应的离子方程式:2A13++3SO42-+3Ba2++8OH-=2A1O2-+3BaSO4↓+4H2O.
(4)已知:NaOH(aq)+HNO3(aq)=NaNO3 (aq)+H2O(1)△H=-akJ•mol-1.请写出B与C的稀溶液反
应的热化学方程式OH-(aq)+H+(aq)=H2O(1)△H=-a kJ/mol或1/2Ba(OH)2(aq)+HC1(aq)=1/2BaC12(aq)+H2O(1)△H=-a kJ/mol或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2akJ/mol.
分析 ①A、B两溶液呈碱性,结合离子的共存可知,应为Ba(OH)2、Na2CO3中的一种,C、D、E溶液呈酸性,应为AgNO3、硫酸铝、HCl中的一种;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生,则A为Na2CO3,B为Ba(OH)2,E为Al2(SO4)3,C为HCl;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀,则D为AgNO3,然后结合物质的性质及化学用语来解答.
解答 解:①A、B两溶液呈碱性,结合离子的共存可知,应为Ba(OH)2、Na2CO3中的一种,C、D、E溶液呈酸性,应为AgNO3、硫酸铝、HCl中的一种;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生,则A为Na2CO3,B为Ba(OH)2,E为Al2(SO4)3,C为HCl;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀,则D为AgNO3,
(1)上述分析可知B为Ba(OH)2,C为HCl,
故答案为:Ba(OH)2; HCl;
(2)A溶液与E溶液反应的化学方程式为3Na2CO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CO2↑+3Na2SO4,
故答案为:3Na2CO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CO2↑+3Na2SO4;
(3)E溶液与过量的B溶液反应的离子方程式为2A13++3SO42-+3Ba2++8OH-=2A1O2-+3BaSO4↓+4H2O,
故答案为:2A13++3SO42-+3Ba2++8OH-=2A1O2-+3BaSO4↓+4H2O;
(4)B与C的稀溶液反应的热化学方程式为OH-(aq)+H+(aq)=H2O(1)△H=-a kJ/mol或1/2Ba(OH)2(aq)+HC1(aq)=1/2BaC12(aq)+H2O(1)△H=-a kJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2a kJ/mol,
故答案为:OH-(aq)+H+(aq)=H2O(1)△H=-a kJ/mol或1/2Ba(OH)2(aq)+HC1(aq)=1/2BaC12(aq)+H2O(1)△H=-a kJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2a kJ/mol.
点评 本题考查离子的共存及物质的推断,明确信息中物质之间的反应为解答的关键,熟悉离子之间的反应即可解答,题目难度中等.

 精英口算卡系列答案
精英口算卡系列答案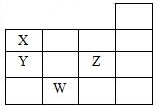 如图表示元素周期表的一部分,关于元素X、Y、Z、W的叙述正确的是( )
如图表示元素周期表的一部分,关于元素X、Y、Z、W的叙述正确的是( )①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性为Y<Z
③W的单质是半导体材料
④W的原子序数比Y大9.
| A. | 只有③ | B. | 只有①③ | C. | 只有①②③ | D. | ①②③④ |
| A. | NaOH、KOH、CsOH碱性依次增强 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | Al3+、Mg2+、Na+的离子半径依次减小 | |
| D. | O22-和S2-具有相同的质子数和电子数 |
| A. | 7 | B. | 10 | C. | 4.3 | D. | 11.7 |
| A. | 能使溴水褪色 | B. | 不能发生加成反应 | ||
| C. | 能使酸性KMnO4溶液褪色 | D. | 能发生氧化反应 |
| A. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧的原子结构示意图: | |
| C. | NaCl的电子式: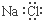 | |
| D. | 质量数为37的氯原子:${\;}_{34}^{17}$Cl |

 ,
, .
.