题目内容
9.短周期元素A、B、C、D、E 的原子序数依次递增,A原子最外层电子数是次外层电子数的2 倍,C 的氢化物在常温下为液体,C 和D 的化合物可以制造高性能通讯材料,E 元素的最高化合价和最低化合价的代数和为6.下列叙述错误的是( )| A. | E 元素处于元素周期表中第3 周期第ⅦA 族 | |
| B. | 元素A、B、C 的原子半径:C>B>A | |
| C. | 元素B、C、D 的非金属性:C>B>D | |
| D. | 一定条件下,A 单质可以将D 单质从其氧化物中置换出来 |
分析 短周期元素A、B、C、D、E的原子序数依次递增,A原子最外层电子数是次外层电子数的2倍,A原子只能有2个电子层,最外层电子数为4,则A为C元素;C的氢化物在常温下为液体,C和D的化合物可以制造高性能通讯材料,则C为O元素、D为Si;B的原子序数介于碳、氧之间,故B为N元素;E元素的最高化合价和最低化合价的代数和为6,处于ⅦA族,则E为Cl,结合元素周期律解答.
解答 解:短周期元素A、B、C、D、E的原子序数依次递增,A原子最外层电子数是次外层电子数的2倍,A原子只能有2个电子层,最外层电子数为4,故A为C元素;C的氢化物在常温下为液体,C和D的化合物可以制造高性能通讯材料,则C为O元素,D为Si;B的原子序数介于碳、氧之间,故B为N元素;E元素的最高化合价和最低化合价的代数和为6,处于ⅦA族,则E为Cl,
A.E为Cl元素,处于周期表中第3周期第ⅦA族,故A正确;
B.同一周期中原子序数越大,原子半径越小,则原子半径大小为:C>N>O,故B错误;
C.根据非金属性O>N>C、C>Si可知非金属性:O>N>Si,故C正确;
D.根据2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,C单质能够置换出Si单质,故D正确;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
20.下列各对物质中,属于同系物的是( )
| A. | C2H4 C4H8 | B. | CH4 C3H8 | C. | CH4 C5H10 | D. | CH3COOH C2H6 |
4.已知位于同周期的X、Y、Z三种主族元素,它们的最高价氧化物的水化物分别为HXO4、H2YO4、H3ZO4,下列判断不正确的是( )
| A. | 元素的非金属性:X>Y>Z | |
| B. | 在元素周期表中它们依次处于第ⅦA族、第ⅥA族、第ⅤA族 | |
| C. | 酸性:H3ZO4>H2YO4>HXO4 | |
| D. | 气态氢化物的稳定性:HX>H2Y>ZH3 |
14.下列性质的递变规律不正确的是( )
| A. | NaOH、KOH、CsOH碱性依次增强 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | Al3+、Mg2+、Na+的离子半径依次减小 | |
| D. | O22-和S2-具有相同的质子数和电子数 |
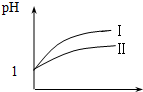 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0. .
. ③CH3CH2Br④
③CH3CH2Br④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ ⑩
⑩

 ,
, .
.