题目内容
6.已知某有机物分子中H原子个数为偶数,若将2.25克该有机物在足量氧气中完全燃烧,得到4.4克CO2和2.25克的H2O,则下列说法不正确的是( )| A. | 可以确定该有机物的相对分子量为90 | |
| B. | 可以确定该有机物的分子式为C4H10O2 | |
| C. | 该有机物中碳、氢、原子个数比为2:5:1 | |
| D. | 因为不知道其相对分子量,故无法确定其分子式 |
分析 4.4g二氧化碳的物质的量为:$\frac{4.4g}{44g/mol}$=0.1mol,根据C原子守恒,2.25g该有机物分子中含有C的物质的量为0.1mol,质量为:12g/mol×0.1mol=1.2g,
2.25g水的物质的量为:$\frac{2.25g}{18g/mol}$=0.125mol,根据H原子守恒,2.25g该有机物分子中含有H的物质的量为:0.125mol×2=0.25mol,质量为:1g/mol×0.25mol=0.25g,
由于1.2g+0.25g=1.45g<2.25g,说明该有机物分子中含有O原子,质量为:2.25g-1.45g=0.8g,含有O的物质的量为:$\frac{8g}{16g/mol}$=0.5mol,
该有机物分子中C、H、O的物质的量之比为0.1mol:0.25mol:0.5mol=2:5:1,该有机物的最简式为C2H5O,根据H原子个数为偶数可知该有机物化学式至少为:C4H10O2,由于该化学式中H原子已经达到饱和,则该有机物的分子式为C4H10O2,据此进行解答.
解答 解:4.4g二氧化碳的物质的量为:$\frac{4.4g}{44g/mol}$=0.1mol,根据C原子守恒,2.25g该有机物分子中含有C的物质的量为0.1mol,质量为:12g/mol×0.1mol=1.2g,
2.25g水的物质的量为:$\frac{2.25g}{18g/mol}$=0.125mol,根据H原子守恒,2.25g该有机物分子中含有H的物质的量为:0.125mol×2=0.25mol,质量为:1g/mol×0.25mol=0.25g,
由于1.2g+0.25g=1.45g<2.25g,说明该有机物分子中含有O原子,质量为:2.25g-1.45g=0.8g,含有O的物质的量为:$\frac{8g}{16g/mol}$=0.5mol,
该有机物分子中C、H、O的物质的量之比为0.1mol:0.25mol:0.5mol=2:5:1,该有机物的最简式为C2H5O,根据H原子个数为偶数可知该有机物化学式至少为:C4H10O2,由于该化学式中H原子已经达到饱和,则该有机物的分子式为C4H10O2,
A.该有机物的分子式为C4H10O2,则其相对分子质量为90,故A正确;
B.根据分析可知该有机物的分子式为C4H10O2,故B正确;
C.该有机物分子中C、H、O的物质的量之比为0.1mol:0.25mol:0.5mol=2:5:1,则该有机物中碳、氢、原子个数比为2:5:1,故C正确;
D.由于化学式C4H10O2中H原子已经达到饱和,则该有机物的分子式为C4H10O2,故D错误;
故选D.
点评 本题考查了有机物分子式确定的计算,题目难度不大,明确常见有机物组成、性质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

| A. | 1:1 | B. | 1:2 | C. | 5:3 | D. | 3:2 |
| A. | NaOH、KOH、CsOH碱性依次增强 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | Al3+、Mg2+、Na+的离子半径依次减小 | |
| D. | O22-和S2-具有相同的质子数和电子数 |
| A. | 7 | B. | 10 | C. | 4.3 | D. | 11.7 |
| A. | 能使溴水褪色 | B. | 不能发生加成反应 | ||
| C. | 能使酸性KMnO4溶液褪色 | D. | 能发生氧化反应 |
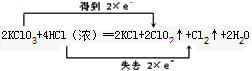 .
. ③CH3CH2Br④
③CH3CH2Br④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ ⑩
⑩

 ,
, .
.