题目内容
12.锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3•H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O(1)写出基态Cu2+的外围电子排布式:[Ar]3d9.
(2)与 Cu 同周期的元素中,与铜原子最外层电子数相等的元素还有K、Cr(填元素符号).
(3)上述反应方程式中,反应物混合溶液中可以互为等电子体的离子有PO43- 和SO42-.
(4)氨基乙酸铜的分子结构如图1,碳原子的杂化方式为sp3、sp2.
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol CN-中含有的π键的数目为2NA,若此配离子与[Cu(H2O)4]2+结构相似,则此配离子的空间构型为:正四面体.
(6)当CN-充当配体时,配位原子是C,判定原因是CN-与CO为等电子体,结构相似,分子中有三个键,即一个σ键,两个π键,但其中一个π键为配位键,使C原子带部分负电荷,N原子带部分正电荷.
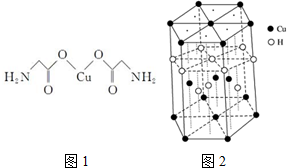
(7)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图2所示.则该化合物的化学式为CuH.
(8)铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0g/cm3.
分析 (1)铜是29号元素,二价铜离子核外有27个电子,根据构造原理写出其核外电子排布式;
(2)铜最外层有1个电子;
(3)根据原子数和价电子数分别相等的两种微粒互为等电子体,可以写出等电子体的分子和离子;
(4)根据碳原子的成键情况要以判断碳原子的杂化方式;
(5)一个 CN-中含有2个π键;
(6)当CN-充当配体时,配位原子是C,CN-与CO为等电子体,结构相似,分子中有三个键,即一个σ键,两个π键;
(7)利用均摊法确定其化学式;
(8)根据$ρ=\frac{m}{V}$计算密度.
解答 解:(1)铜是29号元素,二价铜离子核外有27个电子,根据构造原理知,其核外电子排布式为:[Ar]3d9,
故答案为:[Ar]3d9;
(2)铜最外层有1个电子,在同一周期中最外层一个电子的还有K、Cr,故答案为:K、Cr;
(3)根据原子数和价电子数分别相等的两种微粒互为等电子体,可以写出等电子体的分子和离子分别为:PO43-和SO42-,故答案为:PO43-;SO42-;
(4氨基乙酸铜的分子中一种碳有碳氧双键,碳的杂化方式为sp2杂化,另一种碳周围都是单键,碳的杂化方式为sp3杂化,故答案为:sp3、sp2;
(5)一个 CN-中含有2个π键,所以1mol CN-中含有的π键的数目为:2NA,若此配离子与[Cu(H2O)4]2+结构相似,则此配离子中心原子的价层电子对为4,且不含孤电子对,所以其空间构型正四面体,故答案为:2NA;正四面体;
(6)当CN-充当配体时,配位原子是C,CN-与CO为等电子体,结构相似,分子中有三个键,即一个σ键,两个π键,但其中一个π键为配位键,使C原子带部分负电荷,N原子带部分正电荷,
故答案为:C;CN-与CO为等电子体,结构相似,分子中有三个键,即一个σ键,两个π键,但其中一个π键为配位键,使C原子带部分负电荷,N原子带部分正电荷;
(7)该晶胞中,铜原子个数=4+2×$\frac{1}{2}$+12×$\frac{1}{6}$=7,H原子个数=1+3+6×$\frac{1}{2}$=7,所以其化学式为CuH,故答案为:CuH;
(8)在铜晶胞中含有铜原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,铜的原子半径为127.8pm,所以晶胞的边长为4×$\frac{\sqrt{2}}{2}$×127.8pm,所以晶胞的密度为$\frac{\frac{4×64}{{N}_{A}}}{(4×\frac{\sqrt{2}}{2}×127.8×1{0}^{-10})^{3}}$g/cm3=9.0g/cm3,故答案为:9.0g/cm3.
点评 本题考查了物质结构及性质,这些知识点都是考查热点,难点是化学式的确定,注意该题中每个顶点上的原子被6个晶胞占有而不是8个晶胞占有,为易错点.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案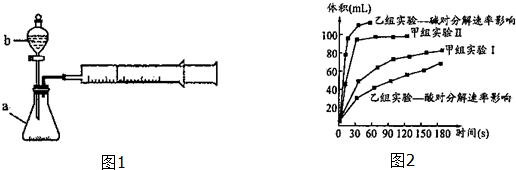
(1)仪器b的名称:分液漏斗.
(2)甲小组有如下实验设计方案,请帮助完成下列填空.
| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
| 甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10ml 5%H2O2 |
①由甲组实验得出的数据可知:浓度越大,H2O2分解速率越快(填“越快”、“越慢”);
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是K2O2;
③乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2,其化学反应方程式为Ba02+H2SO4=H202+BaSO4↓;支持这一方案的理由是制备H202的环境为酸性环境,H202分解速率较慢.
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CC14振荡后,观察下层液体颜色 | |
| C. | 加入CC14振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 加入CC14振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色 |
| A. | 分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液 | |
| B. | 焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 | |
| C. | 生石灰用作食品抗氧剂 | |
| D. | “海水淡化”可以解决“淡水供应危机”,但加入明矾不能使海水淡化 |
| A. | 该电池充电时,锂极与外电源的负极相连 | |
| B. | 该电池放电时,Li+向负极移动 | |
| C. | 该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+ | |
| D. | 若放电时转移 0.2 mol 电子,则消耗锂 1.4x g |
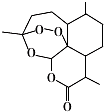
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素中含多个环状结构,其中有一个六元碳环 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
| A. |  称取氢氧化钠 | B. |  浓硫酸稀释 | C. | 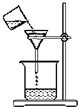 过滤溶液 | D. | 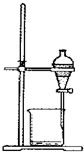 分液操作 |
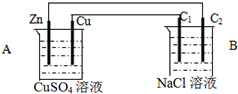 按如图装置进行实验,C1与C2均为石墨棒,回答下列问题
按如图装置进行实验,C1与C2均为石墨棒,回答下列问题