题目内容
用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量10.0g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在 (填编号字母)称量.
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000mol?L-1的盐酸来滴定待测溶液,不可选用 (填编号字母)做指示剂.
A.甲基橙B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视 ;在铁架台上垫一张白纸,其目的是 .
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol?L-1,烧碱样品的纯度是 .
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 .
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果 .
(1)准确称量10.0g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000mol?L-1的盐酸来滴定待测溶液,不可选用
A.甲基橙B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果
考点:中和滴定
专题:实验题
分析:(1)易潮解的药品,必须放在玻璃器皿上(如:小烧杯、表面皿)里称量;
(2)酸碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂;
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,根据溶液颜色的变化判断终点;
(4)根据c(待测)=
,V(标准)用两次的平均值;根据m=c?V?M计算500mL溶液中氢氧化钠的质量,再根据质量分数公式计算氢氧化钠的质量分数;
(5)根据操作对c(待测)=
产生的影响分析误差.
(2)酸碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂;
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,根据溶液颜色的变化判断终点;
(4)根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(5)根据操作对c(待测)=
| c(标准)×V(标准) |
| V(待测) |
解答:
解:(1)易潮解的药品,必须放在玻璃器皿上(如:小烧杯、表面皿)里称量,防止玷污托盘.因烧碱易潮解,所以应放在小烧杯中称量,故选A;
(2)酸碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂,故选B;
(3)滴定时,滴定过程中两眼应该注视锥形瓶内溶液的颜色变化,在盛放待测溶液的锥形瓶下方放一张白纸的作用是观察锥形瓶中溶液颜色的变化明显,减少实验误差,故答案为:锥形瓶内溶液的颜色变化;便于观察锥形瓶内液体颜色的变化,减小滴定误差;
(4)第一次消耗的标准液的体积为:(20.50-0.40)mL=20.10mL,第二次消耗的标准液体积为:24.00mL-4.10mL=19.90mL,两次滴定数据都是有效的,所以消耗标准液平均体积为20.00mL,
根据c(待测)=
,
=0.4000mol?L-1,
样品中含有烧碱的质量为:m(烧碱)=c?V?M=0.4000mol?L-1×0.5L×40g/mol=8.0g,烧碱的质量分数为:ω=
×100%=80.00%;
故答案为:0.4000;80.00%;
(5)①观察酸式滴定管液面时,开始俯视,滴定终点平视,导致计算出的标准液体积偏大,浓度偏高,故答案为:偏高;
②若若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,导致待测液的物质的量增加,消耗的标准液体积增大,结果偏高,故答案为:偏高.
(2)酸碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂,故选B;
(3)滴定时,滴定过程中两眼应该注视锥形瓶内溶液的颜色变化,在盛放待测溶液的锥形瓶下方放一张白纸的作用是观察锥形瓶中溶液颜色的变化明显,减少实验误差,故答案为:锥形瓶内溶液的颜色变化;便于观察锥形瓶内液体颜色的变化,减小滴定误差;
(4)第一次消耗的标准液的体积为:(20.50-0.40)mL=20.10mL,第二次消耗的标准液体积为:24.00mL-4.10mL=19.90mL,两次滴定数据都是有效的,所以消耗标准液平均体积为20.00mL,
根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
| 0.2000mol?L-1×0.02L |
| 0.01L |
样品中含有烧碱的质量为:m(烧碱)=c?V?M=0.4000mol?L-1×0.5L×40g/mol=8.0g,烧碱的质量分数为:ω=
| 8.0g |
| 10.0g |
故答案为:0.4000;80.00%;
(5)①观察酸式滴定管液面时,开始俯视,滴定终点平视,导致计算出的标准液体积偏大,浓度偏高,故答案为:偏高;
②若若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,导致待测液的物质的量增加,消耗的标准液体积增大,结果偏高,故答案为:偏高.
点评:本题考查了中和滴定操作及误差分析,操作时要规范,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响,本题难度中等.

练习册系列答案
相关题目
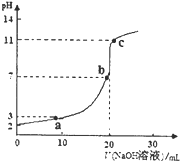 室温时,将0.10mol?L-1 NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图.下列有关说法不正确的是( )
室温时,将0.10mol?L-1 NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图.下列有关说法不正确的是( )| A、该一元酸溶液浓度为0.10mol?L-1 |
| B、a、b、c点的水溶液导电性依次增强 |
| C、室温时,HA的电离常数Ka≈1×10-5 |
| D、a点和c点所示溶液中H2O的电离程度相同 |
下列操作不能达到目的是( )
A、 制取CO2 |
B、 收集氯气 |
C、 检查气密性 |
D、 I2的乙醚溶液中分离I2 |
通过实验可验证蔗糖水解可以生成葡萄糖,实验包括下列操作:其操作的正确顺序是( )
①加入少量蔗糖和水制成溶液 ②水浴加热 ③加入NaOH溶液中和酸并至溶液呈碱性 ④加入新制备的Cu(OH)2 ⑤加入少量稀硫酸 ⑥再加热.
①加入少量蔗糖和水制成溶液 ②水浴加热 ③加入NaOH溶液中和酸并至溶液呈碱性 ④加入新制备的Cu(OH)2 ⑤加入少量稀硫酸 ⑥再加热.
| A、①②⑤⑥④③ |
| B、①⑤②④⑥③ |
| C、①⑤②③④⑥ |
| D、①⑥④⑤③② |
下列有关物质性质或应用的说法正确的是( )
| A、蛋白质水解生成葡萄糖放出热量,提供生命活动的能量 |
| B、次氯酸钠具有强还原性,可用于配制消毒液 |
| C、氯气和二氧化硫都具有漂白性,两者混合使用能提高漂白的效率 |
| D、碳酸钠溶液显碱性,用热的饱和碳酸钠溶液可除去金属表面的油污 |
在AgNO3和Cu(NO3)2的混合溶液中,加入一定量的铁粉,充分反应后,有少量金属析出,过滤,向滤液中滴加盐酸,有白色沉淀生成,该沉淀不溶于稀硝酸,则析出的金属是( )
| A、Cu和 Ag |
| B、Ag |
| C、Cu |
| D、Cu 和 Fe |

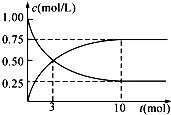 过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示.
过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示.