题目内容
1. 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.(1)天然水在净化处理过程中加入明矾做混凝剂,其净水作用的原理是Al3++3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示)
(2)家庭用水可以用肥皂水检验其硬度,因为高级酯肪酸钠,能与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀.家用净水器中装有活性炭和阳离子交换树脂(NaR),用过的阳离子交换树脂放入食盐水中可再生.
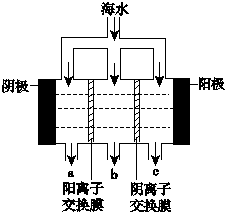
(3)电渗析法淡化海水的示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阳极的主要电极反应式是2Cl--2e-═Cl2↑.在阴极附近加入无色酚酞,看到的现象是阴极附近溶液变红色,有无色气体放出.淡水的出口为b(填“a”“b”或“c”).
(4)利用海水制得的食盐,制取纯碱的简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①滤出晶体C后,从滤液D中提取氯化铵有两种方法:
方法一、通入氨,冷却、加食盐,过滤;
方法二、不通氨,冷却、加食盐,过滤.
对两种方法的评价正确的是(选填编号)ad.
a.方法一析出的氯化铵纯度更高 b.方法二析出的氯化铵纯度更高
c.方法一的滤液可直接循环使用 d.方法二的滤液可直接循环使用
②提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是使Fe3+完全水解为Fe(OH)3.滤渣的主要成分是Fe(OH)3、BaSO4.
分析 (1)明矾可水解生成具有吸附性的胶体;
(2)肥皂中含有高级酯肪酸钠,能与钙离子生成沉淀;用过的阳离子交换树脂中钠离子被钙、镁离子交换掉了,要再生可以放在食盐中,将钙镁离子再换成钠离子;
(3)依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气;阴极是氢离子得到电子发生还原反应生成氢气,阴极附近氢氧根离子浓度增大;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;
(4)①滤液D中含有碳酸氢钠和氯化铵,a.方法一通入氨,使溶液中的碳酸氢钠生成碳酸钠,再加食盐,过滤,析出的氯化铵纯度更高;
b.方法二没有通氨气,冷却、加食盐,过滤,析出的氯化铵中会有碳酸氢钠,纯度不高;
c.方法一的滤液含有碳酸钠不可直接循环使用;
d.方法二的滤液主要成分还是碳酸氢钠和氯化铵,还有氯化钠,可直接循环使用;
②提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,将亚铁离子氧化成铁离子,加热至沸,促使铁离子水解生成氢氧化铁沉淀,再加入BaCl2溶液,使硫酸根离子沉淀,过滤,蒸发结晶,得到工业氯化铵,据此答题;
解答 解:(1)然水在净化处理过程中加入明矾做混凝剂,因明矾水解生成具有吸附性的胶体,反应的离子方程式为Al3++3H2O?Al (OH)3(胶体)+3H+,
故答案为:Al3++3H2O?Al (OH)3(胶体)+3H+;
(2)肥皂中含有高级酯肪酸钠,能与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀;用过的阳离子交换树脂中钠离子被钙、镁离子交换掉了,要再生可以放在食盐中,将钙镁离子再换成钠离子,
故答案为:高级酯肪酸钠,能与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀;食盐水;
(3)依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过,所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑,阴极是氢离子得到电子发生还原反应生成氢气,阴极附近氢氧根离子浓度增大,在阴极附近加入无色酚酞,可以看到阴极附近溶液变红色,有无色气体放出;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出,
故答案为:2Cl--2e-═Cl2↑;阴极附近溶液变红色,有无色气体放出;b;
(4)①滤液D中含有碳酸氢钠和氯化铵,a.方法一通入氨,使溶液中的碳酸氢钠生成碳酸钠,再加食盐,过滤,析出的氯化铵纯度更高,故a正确;
b.方法二没有通氨气,冷却、加食盐,过滤,析出的氯化铵中会有碳酸氢钠,纯度不高,故b错误;
c.方法一的滤液含有碳酸钠不可直接循环使用,故c错误;
d.方法二的滤液主要成分还是碳酸氢钠和氯化铵,还有氯化钠,可直接循环使用,故d正确;
故选ad;
②提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,将亚铁离子氧化成铁离子,加热至沸,促使铁离子水解生成氢氧化铁沉淀,再加入BaCl2溶液,使硫酸根离子沉淀,过滤,蒸发结晶,得到工业氯化铵,所以滤渣的主要成分是,
故答案为:使Fe3+完全水解为Fe(OH)3;Fe(OH)3、BaSO4;
点评 本题以海水资源开发利用为载体,考查了粗盐的提纯、水的净化、硬水的软化、电解食盐水等,是对知识的综合应用,难度中等.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案①过量的锌与18mol/L硫酸溶液反应
②过量的氢气与少量的氮气在催化剂存在下充分反应
③过量的MnO2与浓盐酸反应
④过量铜与浓硫酸反应
⑤过量稀硝酸与铁反应;
⑥过量的水与一定量的氯气反应;
⑦常温下,过量的浓硫酸与铝反应.
| A. | ②③④⑥⑦ | B. | ②③⑤⑦ | C. | ①③⑦ | D. | ①②③④⑥ |

| A. | (1)图显示M中只有一种溶质且为Na2CO3 | |
| B. | (3)图显示M中有两种溶质且为Na2CO3.NaOH | |
| C. | (2)图显示M中有两种溶质且为Na2CO3.NaHCO3 | |
| D. | (4)图显示M中c(NaHCO3)=c(Na2CO3) |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数k=1
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:v(H2O)=$\frac{4}{{Vt}_{1}}$mol/(L•min)
(5)已知:2H2 (g)+O2 (g)=2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)﹦2CO2(g)△H=-566kJ/mol.
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)3CO2+5OH-═2CO32-+HCO3-+2H2O.
| A. | 在KMnO4溶液中:SO42-、Mg2+、CH3CH2OH、NO3- | |
| B. | 在由水电离的氢离子浓度为1×10-12mol/L的溶液中:Fe2+、Na+、NO3-、Cl- | |
| C. | 离子浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ | |
| D. | 无色溶液中:Fe3+、NO3-、Na+、Cl- |
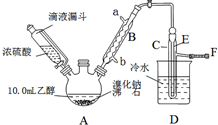 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)实验中用滴液漏斗代替分液漏斗的优点为平衡压强,使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O.
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其目的主要是吸收SO2、Br2、HBr防止空气污染.
(5)图中C中的导管E的末端须在水面以下,其目的是使溴乙烷充分冷凝,提高产率.
(6)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品.
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.