题目内容
10.下列各组粒子在指定溶液中一定能大量共存的一组是( )| A. | 在KMnO4溶液中:SO42-、Mg2+、CH3CH2OH、NO3- | |
| B. | 在由水电离的氢离子浓度为1×10-12mol/L的溶液中:Fe2+、Na+、NO3-、Cl- | |
| C. | 离子浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ | |
| D. | 无色溶液中:Fe3+、NO3-、Na+、Cl- |
分析 A.高锰酸钾能够氧化乙醇;
B.该溶液可能为酸性或碱性溶液,亚铁离子与氢氧根离子反应,酸性条件下硝酸根离子氧化亚铁离子;
C.四种离子之间不反应,能够大量共存;
D.铁离子为有色离子.
解答 解:A.KMnO4溶液有强氧化性,不能和CH3CH2OH共存,故A错误;
B.由水电离的氢离子浓度为1×10-12mol/L的溶液可能是酸性,也可能是碱性,但不管哪一种溶液Fe2+都不能存在,故B错误;
C.离子浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+能共存,故C正确;
D.无色溶液中Fe3+不能共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
20. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10s时,用Z表示的反应速率为0.158 mol•(L•s)-1 | |
| B. | 反应开始到10s时,X的物质的量浓度减少了0.79 mol•L-1 | |
| C. | 反应的化学方程式为X(g)+Y(g)?2Z(g) | |
| D. | 反应开始到10 s时,Y的转化率为39.5% |
18.下列化学符号中,数字“2”表示的意义不正确的是( )
| A. | 2Na:两个钠元素 | |
| B. | 2OH-:两个氢氧根离子 | |
| C. | $\stackrel{+2}{M}$g:镁元素的化合价为+2价 | |
| D. | NO2:一个二氧化氮分子含有两个氧原子 |
5.在298K、1.01×105 Pa下,将22g CO2通入750mL 1mol•L-1 NaOH 溶液中充分反应,测得反应放出x kJ的热量.已知在该条件下,1molCO2通入1L 2mol•L-1 NaOH溶液中充分反应放出ykJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的( )
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
15.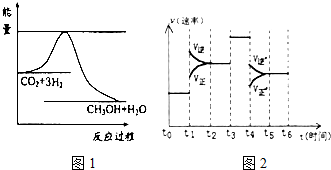 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是d (填字母).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2mol H-O键
c. v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的逆反应为吸 (填“吸”或“放”)热反应
②若实验3要达到与实验2中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是b=2a且a>l (用含a、b的数学式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)图1表示该反应进行过程中能量(单位为kJ?mol.)的变化.
①在体积为1L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使 c (CH3OH)增大的是cd (填字母)
a.升高温度
b.充入He (g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入l mol CO2和3molH2
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图2:其中表示平衡混合物中CH3OH含量最高的一段时间是t0~t1;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,则K1大于K2(填“大于”、“等于”或“小于”).
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是d (填字母).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2mol H-O键
c. v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |
②若实验3要达到与实验2中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是b=2a且a>l (用含a、b的数学式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)图1表示该反应进行过程中能量(单位为kJ?mol.)的变化.
①在体积为1L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使 c (CH3OH)增大的是cd (填字母)
a.升高温度
b.充入He (g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入l mol CO2和3molH2
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图2:其中表示平衡混合物中CH3OH含量最高的一段时间是t0~t1;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,则K1大于K2(填“大于”、“等于”或“小于”).
2.下列关于钠的化合物的说法正确的是( )
| A. | 等物质的量NaHCO3、Na2CO3分别与同浓度盐酸完全反应,消耗的盐酸体积Na2CO3是NaHCO3的二倍 | |
| B. | Na2O2和Na2O均可以和盐酸反应生成相应的盐,都属于碱性氧化物 | |
| C. | 将澄清石灰水分别加入NaHCO3和Na2CO3两种盐溶液中,只有Na2CO3溶液产生沉淀 | |
| D. | Na2O2和Na2O中Na2O更稳当,Na2O2在一定条件下可以转化为Na2O |
19.某探究性学习小组设计如图1所示装置分别进行如下探究实验,请回答下列问题:
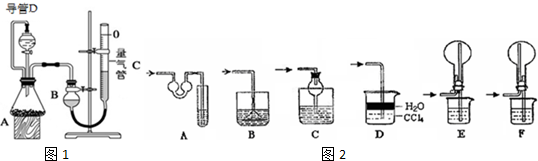
(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准;
(2)实验Ⅱ中量气管中的液体最好是C(填字母编号,下同)
A.NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
实验剩余的NH3需吸收处理,以下各种尾气吸收装置如图2中,不能防止倒吸的是BE;
(3)①写出实验Ⅲ中涉及的离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑;
②反应前,先对量气管进行第一次读数.读数时,应注意的操作是保持装置B与装置C液面相平,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数.实验前,如拆去导管D,测得的气体体积将偏大(填“偏大”、“偏小”、或“无影响”).
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
根据上述数据,计算出镁铝合金中铝的质量分数为26.9%.
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |

(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准;
(2)实验Ⅱ中量气管中的液体最好是C(填字母编号,下同)
A.NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
实验剩余的NH3需吸收处理,以下各种尾气吸收装置如图2中,不能防止倒吸的是BE;
(3)①写出实验Ⅲ中涉及的离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑;
②反应前,先对量气管进行第一次读数.读数时,应注意的操作是保持装置B与装置C液面相平,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数.实验前,如拆去导管D,测得的气体体积将偏大(填“偏大”、“偏小”、或“无影响”).
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 376.6mL |
| ② | 1.0g | 10.0mL | 364.7mL |
| ③ | 1.0g | 10.0mL | 377.0mL |
20.必须加入氧化剂才能实现的变化是( )
| A. | KClO3→O2 | B. | CO2→CO | C. | Fe→Fe3O4 | D. | CuO→CuSO4 |
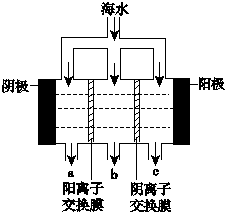 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.