题目内容
13.工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数k=1
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:v(H2O)=$\frac{4}{{Vt}_{1}}$mol/(L•min)
(5)已知:2H2 (g)+O2 (g)=2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)﹦2CO2(g)△H=-566kJ/mol.
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)3CO2+5OH-═2CO32-+HCO3-+2H2O.
分析 (1)正反应为放热反应,则断键吸收的总能量小于成键放出的总能量;
(2)平衡时放出热量为32.8 kJ,则参加反应的CO为$\frac{32.8kJ}{41kJ/mol}$=0.8mol,进而计算CO转化率;
(3)容器①、②温度相同,平衡常数相同,根据容器①中消耗CO物质的量,计算平衡时各物质的物质的量,反应前后气体体积不变,用物质的量代替浓度代入K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算平衡常数;
(4)a.容器①、②中CO、H2O起始物质的量之比均为1:4,反应前后气体体积不变,恒温恒容下二者为等效平衡,平衡时同种物质的含量相等;
b.容器①、②为等效平衡,平衡时CO转化率相等,计算容器②中反应CO的物质的量,结合热化学方程式计算放出的热量;
c.浓度越大,反应速率越快;
d.由方程式可知生成的水的物质的量等于消耗CO物质的量,根据v=$\frac{△c}{△t}$计算v(H2O);
(5)已知:①CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol
②2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,
根据盖斯定律,①×2+②可得:2CO(g)+O2(g)﹦2CO2(g);
(6)(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol,n(NaOH)=0.2L×5mol/L=1mol,1:2<n(CO2):n(NaOH)=0.6:1=3:5<1:1,故生成Na2CO3、NaHCO3,根据钠离子守恒、碳原子守恒列方程计算Na2CO3、NaHCO3的物质的量,进而书写离子方程式.
解答 解:(1)正反应为放热反应,反应物分子化学键断裂时所吸收的总能量小于生成物分子化学键形成时所释放的总能量,
故答案为:小于;
(2)平衡时放出热量为32.8 kJ,则参加反应的CO为$\frac{32.8kJ}{41kJ/mol}$=0.8mol,则CO转化率为$\frac{0.8mol}{1mol}$×100%=80%,
故答案为:80%;
(3)容器①、②温度相同,平衡常数相同,容器①中消耗CO物质的量为0.8mol,则:
CO(g)+H2O(g)═CO2(g)+H2(g)
起始量(mol):1 4 0 0
变化量(mol):0.8 0.8 0.8 0.8
平衡量(mol):0.2 3.2 0.8 0.8
反应前后气体体积不变,用物质的量代替浓度计算平衡常数,则K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.8×0.8}{0.2×3.2}$=1,
故答案为:1;
(4)a.容器①、②中CO、H2O起始物质的量之比均为1:4,反应前后气体体积不变,恒温恒容下二者为等效平衡,两容器中H2的体积分数相等,故a正确;
b.容器①、②为等效平衡,平衡时CO转化率相等,容器②中反应CO的物质的量为2mol×80%=1.6mol,放出的热量为1.6mol×41kJ/mol=65.6kJ,故b错误;
c.容器②中反应物起始浓度比①中的大,故容器②中开始反应速率较快,故c错误;
d.由方程式可知生成的水的物质的量等于消耗CO物质的量,则v(H2O)=$\frac{\frac{0.8mol}{VL}}{{t}_{1}min}$=$\frac{0.8}{V{t}_{1}}$mol/(L.min),故d错误,
故选:a;
(5)已知:①CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol
②2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,
根据盖斯定律,①×2+②可得:2CO(g)+O2(g)﹦2CO2(g)△H=-566kJ/mol,
故答案为:2CO(g)+O2(g)﹦2CO2(g)△H=-566kJ/mol;
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol,n(NaOH)=0.2L×5mol/L=1mol,1:2<n(CO2):n(NaOH)=0.6:1=3:5<1:1,故生成Na2CO3、NaHCO3,设Na2CO3、NaHCO3的物质的量分别为xmol、ymol,则$\left\{\begin{array}{l}{x+y=0.6}\\{2x+y=1}\end{array}\right.$,解得x=0.4,y=0.2,故反应离子方程式为:3CO2+5OH-═2CO32-+HCO3-+2H2O;
故答案为:3CO2+5OH-═2CO32-+HCO3-+2H2O.
点评 本题考查化学平衡计算与影响因素、平衡常数、盖斯定律应用、离子方程式书写等,注意理解效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化一边,对应物质满足等比,2:恒温恒压,按化学计量数转化一边,对应物质满足等比.

 名校课堂系列答案
名校课堂系列答案| A. | 2Na+2NH3=2NaNH2+H2↑ | B. | NH3+HCl=NH4Cl | ||
| C. | 4NH3+6NO=5N2+6H2O. | D. | 3SiH4+4NH3=Si3N4+12H2 |
| A. | 2Na:两个钠元素 | |
| B. | 2OH-:两个氢氧根离子 | |
| C. | $\stackrel{+2}{M}$g:镁元素的化合价为+2价 | |
| D. | NO2:一个二氧化氮分子含有两个氧原子 |
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
| A. | 等物质的量NaHCO3、Na2CO3分别与同浓度盐酸完全反应,消耗的盐酸体积Na2CO3是NaHCO3的二倍 | |
| B. | Na2O2和Na2O均可以和盐酸反应生成相应的盐,都属于碱性氧化物 | |
| C. | 将澄清石灰水分别加入NaHCO3和Na2CO3两种盐溶液中,只有Na2CO3溶液产生沉淀 | |
| D. | Na2O2和Na2O中Na2O更稳当,Na2O2在一定条件下可以转化为Na2O |

此流程的第Ⅰ步反应为:CH4+H2O?CO+3H2,一定条件下CH4的平衡转化率与温度、压强的关系如图2.则P1<P2.100℃时,将1mol CH4和2mol H2O通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=2.25×10-4(.
此流程的第Ⅱ步反应的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO、CH3OH的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH不完全燃烧生成CO和H2O的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
②合成甲醇的方程式为:CO+2H2?CH3OH△H<0.在230°C〜270℃最为有利.为研究合成气最合适的起始组成比n:n,分别在230℃、250℃和270℃进行实验,结果如图4所示.其中270℃的实验结果所对应的曲线是Z;当曲线X、Y、Z对应的投料比达到相同的CO平衡转化率时,对应的反应温度与投较比的关系是投料比越高,对应的反应温度越高.
③当投料比为1:1,温度为230℃,平衡混合气体中,CH3OH的物质的量分数为33.3%.

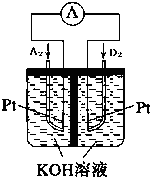 A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答: .
.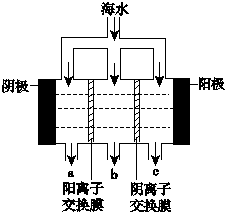 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.