题目内容
12.已知浓度为0.01mol•L-1的HCl溶液VmL,加水稀释到2VmL,取出10mL,则这10mL溶液中c(H+)0.005mol/L.分析 根据稀释定律,稀释前后溶质物质的量不变,据此计算稀释后溶液中氢离子浓度,溶液是均一的,取出溶液浓度与原溶液浓度相等.
解答 解:浓度为0.01mol•L-1的HCl溶液VmL,加水稀释到2VmL,根据稀释定律,稀释后氢离子浓度为$\frac{0.01mol/L×VmL}{2VmL}$=0.005mol/L,溶液是均一的,取出溶液浓度与原溶液浓度相等,即从稀释后溶液中取出的10mL溶液中c(H+)=0.005mol/L,
故答案为:0.005.
点评 本题考查物质的量浓度计算,比较基础,注意对物质的量浓度定义式理解与灵活应用.

练习册系列答案
相关题目
20. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10s时,用Z表示的反应速率为0.158 mol•(L•s)-1 | |
| B. | 反应开始到10s时,X的物质的量浓度减少了0.79 mol•L-1 | |
| C. | 反应的化学方程式为X(g)+Y(g)?2Z(g) | |
| D. | 反应开始到10 s时,Y的转化率为39.5% |
2.下列关于钠的化合物的说法正确的是( )
| A. | 等物质的量NaHCO3、Na2CO3分别与同浓度盐酸完全反应,消耗的盐酸体积Na2CO3是NaHCO3的二倍 | |
| B. | Na2O2和Na2O均可以和盐酸反应生成相应的盐,都属于碱性氧化物 | |
| C. | 将澄清石灰水分别加入NaHCO3和Na2CO3两种盐溶液中,只有Na2CO3溶液产生沉淀 | |
| D. | Na2O2和Na2O中Na2O更稳当,Na2O2在一定条件下可以转化为Na2O |

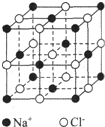
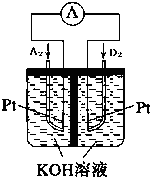 A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答: .
.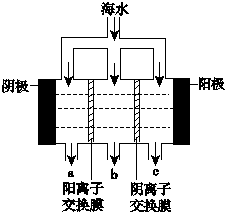 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.