题目内容
10.现有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4g C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子.(1)C在周期表中的位置第三周期ⅡA族.
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为HF>HCl>H2S(用化学式表示).
(3)写出淡黄色固体E的电子式
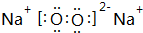 ,其中含有的化学键为离子键、共价键.
,其中含有的化学键为离子键、共价键.(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它们的物质的量之比为1:2.
分析 短周期元素中,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A的质子数为8,即A为O元素;B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na元素;C为原子核内有12个中子的二价金属,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,设C的相对原子质量为x,由电子守恒可知,$\frac{2.4g}{xg/mol}$×2=$\frac{2.24L}{22.4L/mol}$×2,则x=24,其质子数为24-12=12,故C为Mg元素;D的M层上7个电子,则D在第三周期第ⅦA族,则D为Cl元素.
解答 解:短周期元素中,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A的质子数为8,即A为O元素;B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na元素;C为原子核内有12个中子的二价金属,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,设C的相对原子质量为x,由电子守恒可知,$\frac{2.4g}{xg/mol}$×2=$\frac{2.24L}{22.4L/mol}$×2,则x=24,其质子数为24-12=12,故C为Mg元素;D的M层上7个电子,则D在第三周期第ⅦA族,则D为Cl元素.
(1)C为Mg元素,在周期表中位置:第三周期ⅡA族,故答案为:第三周期ⅡA族;
(2)非金属性F>Cl>S,故氢化物稳定性:HF>HCl>H2S,故答案为:HF>HCl>H2S;
(3)淡黄色固体E为Na2O2,电子式为 ,含有离子键、共价键,
,含有离子键、共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(4)设KO2为xmol,K2O2为ymol,则:
4KO2+2CO2═2K2CO3+3O2
4 2 3
x $\frac{x}{2}$ $\frac{3}{4}$x
2K2O2+2CO2═2K2CO3+O2
2 2 1
y y 0.5y
则有:$\frac{x}{2}$+y=$\frac{3}{4}$x+0.5y,
解得 y:x=1:2,
故答案为:1:2.
点评 本题考查位置结构性质的关系,利用氧化还原反应中电子守恒等来推断元素是解题关键,(4)注意根据题目信息明确发生的反应,难度中等.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案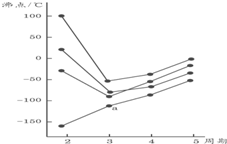
| A. | H2S | B. | CH4 | C. | PH3 | D. | SiH4 |
| A. | 3 mol•L-1氨水 | B. | 4 mol•L-1 HNO3 | ||
| C. | 8 mol•L-1 NaOH | D. | 18 mol•L-1 H2SO4 |
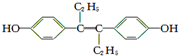
| A. | M的分子式为C18H20O2 | |
| B. | 1 mol M与饱和溴水混合,最多消耗5 mol Br2 | |
| C. | 1 mol M最多能与7 mol H2发生加成反应 | |
| D. | M与NaOH溶液或NaHCO3溶液均能反应 |
| A. | 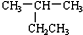 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH═CHCH3 丁烯 | ||
| C. | 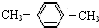 对二甲苯 对二甲苯 | D. | 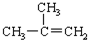 2-甲基-2-丙烯 2-甲基-2-丙烯 |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | Ba(OH)2•8H2O晶体与氯化铵固体的反应 | |
| B. | 氢氧化钠溶液与盐酸反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | 高温煅烧石灰石 |
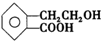 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.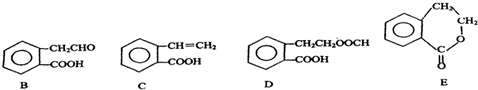
 .
. +2NaOH→
+2NaOH→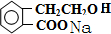 +HCOONa+H2O.
+HCOONa+H2O. .
.