题目内容
相同溶质的两份溶液,一份质量分数为W1,密度为ρ1g?cm-3,浓度为amol?L-1,另一份质量分数为W2,密度为 ρ2g?cm-3,浓度为b mol?L-1,若2a=b,W2<2W1,则ρ1与ρ2的大小关系是( )
| A、ρ1=ρ2 |
| B、ρ1<ρ2 |
| C、ρ1>ρ2 |
| D、无法比较 |
考点:物质的量浓度的相关计算,溶液中溶质的质量分数及相关计算
专题:计算题
分析:根据c=
和2a=b找出密度和质量分数之间关系,再利用题目所给条件判断.
| 1000ρω |
| M |
解答:
解:根据c=
可得,a=
,b=
,由2a=b可知:2ρ1ω1=ρ2ω2,因2ω1>ω2,可知ρ1<ρ2,故选C.
| 1000ρω |
| M |
| 1000ρ1ω1 |
| M |
| 1000ρ2ω2 |
| M |
点评:本题考查了物质的量浓度与密度、质量分数、摩尔质量之间关系,难度中等,熟悉公式:c=
是解题的关键.
| 1000ρω |
| M |

练习册系列答案
相关题目
密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时同的变化如图所示.下列说法中不正确是( )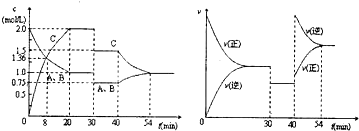

| A、该反应可以表示为A(g)+B(g)?2C(g),△H>0 |
| B、从反应开始到40min,反应物B的转化率为62.5% |
| C、30min后研究的是压强对反应速率和化学平衡的影响,40min后则是温度的影响 |
| D、在20min-30min,30min-40min的反应的平衡常数相等 |
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水.当K闭合时,阴离子交换膜处的SO42-从右向左移动.下列分析正确的是( )
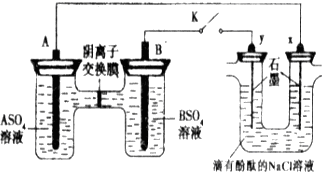

| A、A的金属活动性弱于B |
| B、Na+从y电极趋向x电极 |
| C、Y电极附近溶液先变红 |
| D、B的电极反应:B-2e-=B2+ |
下列各组反应,均可用同一离子方程式表示的是( )
| A、HCl和Na2CO3溶液反应,HCl溶液和CaCO3反应 |
| B、足量稀H2SO4和Na2CO3溶液反应,足量稀HNO3和K2CO3溶液反应 |
| C、稀H2SO4和Ba(OH)2溶液反应,稀H2SO4和KOH溶液反应 |
| D、BaCO3和稀 H2SO4溶液反应,BaCO3和稀HCl 溶液反应 |
现有mg如下化合物充分燃烧后,将其燃烧产物通入过量的过氧化钠固体,固体物质增加质量大于mg的是( )
| A、CO |
| B、C2H4O2 |
| C、C3H6O2 |
| D、C3H4O4 |
下列说法正确的是( )
| A、液态HCl不导电,所以HCl是非电解质 |
| B、NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质 |
| C、铜、石墨均导电,所以它们都是电解质 |
| D、蔗糖在水溶液中或熔融时均不导电,所以是非电解质 |
与100mL 0.1mol/L的NaCl溶液中Cl-离子浓度相同的是( )
| A、50 mL 0.2 mol/L的NaCl溶液 |
| B、50 mL 0.05 mol/L的MgCl2溶液 |
| C、50 mL 0.2 mol/L的HCl溶液 |
| D、100 mL 0.2 mol/L的KCl溶液 |
在相同温度下,在体积相同的两个密闭容器内充入等质量的CO2和SO2气体,则下列说法正确的是( )
| A、CO2和SO2中物质的量比为 1:1 |
| B、CO2和SO2的密度比为1:1 |
| C、CO2和SO2的物质的量浓度比为11:16 |
| D、CO2和SO2中所含氧原子个数比为1:1 |