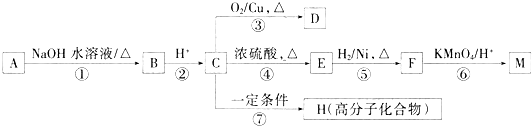
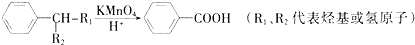题目内容
将0.1mol两种气态烃组成的混合气体完全燃烧后得到3.36L(标准状况)CO2和3.6gH2O,下列说法正确的是( )
| A、一定有乙烯 |
| B、一定有甲烷 |
| C、一定没有甲烷 |
| D、一定没有乙烷 |
考点:有机物的推断
专题:烃及其衍生物的燃烧规律
分析:标况下3.36L二氧化碳的物质的量为:n(CO2)=
=0.15mol,3.6g水的物质的量为:n(H2O)=
=0.2mol,则混合的平均化学式为,C1.5H4,由于是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,以此进行解答.
| 3.36L |
| 22.4L/mol |
| 3.6g |
| 18g/mol |
解答:
解:标况下3.36L二氧化碳的物质的量为:n(CO2)=
=0.15mol,3.6g水的物质的量为:n(H2O)=
=0.2mol,1mol混合气体完全燃烧生成1.5mol二氧化碳、2mol水,则混合的平均化学式为:C1.5H4,由于两种气态烃的混合物,则一定含有C原子数小于1.5的烃,所以一定含有甲烷,
又由于甲烷中含4个氢原子,则另一种烃也含有4个氢原子,
根据以上分析可知,混合气体中一定含有甲烷,所以B正确,C错误;可能含有乙烯,所以A错误,一定没有乙烷,所以D正确,
故选BD.
| 3.36L |
| 22.4L/mol |
| 3.6g |
| 18g/mol |
又由于甲烷中含4个氢原子,则另一种烃也含有4个氢原子,
根据以上分析可知,混合气体中一定含有甲烷,所以B正确,C错误;可能含有乙烯,所以A错误,一定没有乙烷,所以D正确,
故选BD.
点评:本题考查了有机物分子式的计算,题目难度中等,注意掌握利用平均分子组成判断烃的组成的方法,常用方法有:平均碳法、平均氢法、平均碳氢分子式法、平均式量法等.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是( )
| A、Na2O |
| B、Na2O2 |
| C、Na2O和Na2O2 |
| D、Na2O2和NaO2 |
下列与有机结构、性质相关的叙述中,正确的是( )
| A、油脂水解的产物是氨基酸和甘油 |
| B、乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 |
| C、乙醇、乙酸、乙酸乙酯可以用饱和碳酸钠溶液鉴别 |
| D、蛋白质、淀粉、纤维素、蔗糖都属于有机高分子化合物 |
化学与人类生活、社会可持续发展密切相关.下列有关说法不正确的是( )
| A、开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题 |
| B、高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有危害 |
| C、PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重 |
| D、棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O,故对环境不造成污染 |
 用如图实验装置制取乙酸乙酯.回答以下问题:
用如图实验装置制取乙酸乙酯.回答以下问题: