题目内容
 用如图实验装置制取乙酸乙酯.回答以下问题:
用如图实验装置制取乙酸乙酯.回答以下问题:(1)浓H2SO4的作用是:①
(2)写出A试管中发生反应的化学方程式
(3)B试管中所装液体应为
(4)该装置用球形干燥管代替长导管,并将干燥管的末端插入B中液面以下,在此处球形干燥管的作用有①
考点:乙酸乙酯的制取
专题:实验设计题
分析:(1)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动;
(2)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(3)B中试剂起着分离除杂的作用,考虑乙酸乙酯的密度,分离互不相溶的液体,可以分液方法分离;
(4)球形干燥管容积较大,可起到防止倒吸的作用,利于乙酸乙酯充分与空气进行热交换,起到冷凝的作用.
(2)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(3)B中试剂起着分离除杂的作用,考虑乙酸乙酯的密度,分离互不相溶的液体,可以分液方法分离;
(4)球形干燥管容积较大,可起到防止倒吸的作用,利于乙酸乙酯充分与空气进行热交换,起到冷凝的作用.
解答:
解:(1)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动,故答案为:催化剂;吸水剂;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,可为CH3COOH+C2H5OH
CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O;
(3)乙酸和乙醇易挥发,故制得乙酸乙酯中含乙酸和乙醇,加入碳酸钠,可吸收乙醇,中和乙酸,降低乙酸乙酯的溶解度;由于乙酸乙酯密度比水小,故生成乙酸乙酯在上层,分离乙酸乙酯和水溶液,采用分液漏斗进行分液,故答案为:饱和碳酸钠溶液;上;分液漏斗;
(4)球形干燥管容积较大,可起到防止倒吸的作用,使乙酸乙酯充分与空气进行热交换,起到冷凝的作用,故答案为:使乙酸乙酯充分冷凝;防止倒吸.
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,可为CH3COOH+C2H5OH
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
(3)乙酸和乙醇易挥发,故制得乙酸乙酯中含乙酸和乙醇,加入碳酸钠,可吸收乙醇,中和乙酸,降低乙酸乙酯的溶解度;由于乙酸乙酯密度比水小,故生成乙酸乙酯在上层,分离乙酸乙酯和水溶液,采用分液漏斗进行分液,故答案为:饱和碳酸钠溶液;上;分液漏斗;
(4)球形干燥管容积较大,可起到防止倒吸的作用,使乙酸乙酯充分与空气进行热交换,起到冷凝的作用,故答案为:使乙酸乙酯充分冷凝;防止倒吸.
点评:本题主要考查了乙酸乙酯制备实验,题目难度不大,该实验要关注制备的细节如反应条件,催化剂的使用及其产物的除杂提纯等问题.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
下列实验不能达到实验目的是( )
| A、用CaCl2溶液可区别Na2C03和NaHCO3溶液 |
| B、用CC14萃取碘水中的碘 |
| C、用饱和NaHCO3溶液除去C02中的HCl |
| D、检验未知溶液是否含S042-,可先加氯化钡,再加稀盐酸 |
将0.1mol两种气态烃组成的混合气体完全燃烧后得到3.36L(标准状况)CO2和3.6gH2O,下列说法正确的是( )
| A、一定有乙烯 |
| B、一定有甲烷 |
| C、一定没有甲烷 |
| D、一定没有乙烷 |
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)?3C(g)+D(g),若反应开始时充入2molA和1molB,达到平衡时C的浓度为a mol?L-1.若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,c的浓度仍为a mol?L-1的是( )
| A、4mol A+2mol B |
| B、2mol A+1mol B+3mol C+1mol D |
| C、3mol C+1mol D+1mol B |
| D、3mol C+1mol D |
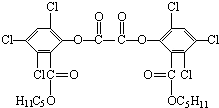 “魔棒”常被用于晚会现场气氛的渲染.其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )
“魔棒”常被用于晚会现场气氛的渲染.其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )| A、CPPO属于芳香烃 |
| B、CPPO属于高分子化合物 |
| C、1mol CPPO与氢氧化钠稀溶液反应(假设苯环上卤素不水解),最多消耗6mol NaOH |
| D、1mol CPPO与氢气完全反应,需要氢气10mol |
对于常温下PH=10的氨水,下列说法正确的是( )
| A、该溶液与PH=10的 Ba(OH)2溶液,溶质的物质的量浓度之比为2:1 |
| B、该溶液由水电离出来的c(H+)与PH=4的NH4Cl溶液相同 |
| C、降低温度,溶液的c(NH4+)/c(NH3?H3O)减小,PH降低 |
| D、往该溶液中加入足量的NH4Cl固体后,c(NH4+)+c(NH3?H3O)=c(Cl-) |
