题目内容
铅蓄电池在放电时的负极反应为 ,其在充电时阳极反应为 ,放电生成的固体会附聚在电极表面,工作过程中若正极质量增重96g时,理论上电路中转移的电子数为 NA ,此过程中电池中消耗的 molH2SO4.
考点:常见化学电源的种类及其工作原理
专题:电化学专题
分析:铅蓄电池放电时,负极上Pb失电子发生氧化反应,正极二氧化铅得电子发生还原反应,充电时阴极、阳极电极反应式与负极、正极反应式正好相反;正极由PbO2变为PbSO4,质量增加的量相当于二氧化硫,根据正极增加质量与转移电子正极的关系式计算转移电子数,根据电池反应式计算消耗硫酸物质的量.
解答:
解:铅蓄电池工作时,负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++2SO42-=PbSO4+2H2O;
充电时阳极反应式与正极反应正好相反,则阳极反应式为PbSO4+2H2O-2e-═PbO2+4H++SO42-;
正极由PbO2变为PbSO4,质量增加的量相当于二氧化硫,根据PbO2+2e-+4H++2SO42-=PbSO4+2H2O知,转移电子数=
×2×NA/mol=3NA;
根据PbO2+2e-+4H++2SO42-=PbSO4+2H2O知,消耗硫酸的物质的量
×2=3mol,
故答案为:Pb-2e-+SO42-=PbSO4 ;PbO2+2e-+4H++2SO42-=PbSO4+2H2O;3;3.
充电时阳极反应式与正极反应正好相反,则阳极反应式为PbSO4+2H2O-2e-═PbO2+4H++SO42-;
正极由PbO2变为PbSO4,质量增加的量相当于二氧化硫,根据PbO2+2e-+4H++2SO42-=PbSO4+2H2O知,转移电子数=
| 96g |
| 64g/mol |
根据PbO2+2e-+4H++2SO42-=PbSO4+2H2O知,消耗硫酸的物质的量
| 96g |
| 64g/mol |
故答案为:Pb-2e-+SO42-=PbSO4 ;PbO2+2e-+4H++2SO42-=PbSO4+2H2O;3;3.
点评:本题考查原电池和电解池原理,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,注意放电时正极增加的质量成分,为易错点.

练习册系列答案
相关题目
下列关于电子式的说法不正确的是( )
| A、每种元素的原子都可以写出电子式 |
| B、简单阳离子的电子式与它的离子符号相同 |
| C、阴离子的电子式要加方括号表示 |
| D、电子式就是核外电子排布的式子 |
下列实验不能达到实验目的是( )
| A、用CaCl2溶液可区别Na2C03和NaHCO3溶液 |
| B、用CC14萃取碘水中的碘 |
| C、用饱和NaHCO3溶液除去C02中的HCl |
| D、检验未知溶液是否含S042-,可先加氯化钡,再加稀盐酸 |
将0.1mol两种气态烃组成的混合气体完全燃烧后得到3.36L(标准状况)CO2和3.6gH2O,下列说法正确的是( )
| A、一定有乙烯 |
| B、一定有甲烷 |
| C、一定没有甲烷 |
| D、一定没有乙烷 |
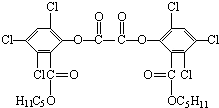 “魔棒”常被用于晚会现场气氛的渲染.其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )
“魔棒”常被用于晚会现场气氛的渲染.其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )| A、CPPO属于芳香烃 |
| B、CPPO属于高分子化合物 |
| C、1mol CPPO与氢氧化钠稀溶液反应(假设苯环上卤素不水解),最多消耗6mol NaOH |
| D、1mol CPPO与氢气完全反应,需要氢气10mol |
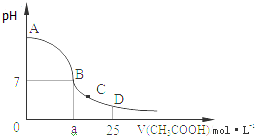 现有常温下的六份溶液:
现有常温下的六份溶液:

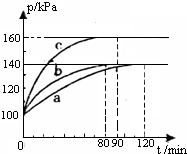 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下.
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下.