题目内容
 铬及其化合物在工业上用重要用途,请回答下列问题:
铬及其化合物在工业上用重要用途,请回答下列问题:(1)基态铬原子的核外电子排布式为
(2)沙瑞特试剂[(C5H5N)2?CrO3]是一种高选择性氧化剂.例如它将乙醇氧化生成乙醛而不继续氧化生成乙酸.
(3)氯化铬酰(CrO2Cl2)熔点:-96.5℃,沸点:117℃,能与CS2等互溶.则固态CrO2Cl2属于
(4)元素Cr的一种氮化物晶体的晶胞结构如图所示,则该化合物的化学式为
(5)已知配合物CrCl3?6H2O中心原子Cr3+配位数为6,向含0.1mol CrCl3?6H2O的溶液中滴加2mol?L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则配离子的化学式为
考点:晶胞的计算,原子核外电子排布,配合物的成键情况
专题:化学键与晶体结构
分析:(1)铬是24号元素,其原子核外有24个电子,根据工作原理写出其基态原子核外电子排布式;
(3)分子晶体的熔沸点较低;二硫化碳和NO2+的结构相似,根据二硫化碳的结构确定NO2+中π键个数;
(4)利用均摊法确定其化学式;根据ρ=
计算密度;
(5)能和硝酸银反应生成白色沉淀的是配合物中外界氯离子,根据硝酸银的物质的量计算配合物化学式中氯离子个数,再根据配位数确定內界,从而确定其化学式.
(3)分子晶体的熔沸点较低;二硫化碳和NO2+的结构相似,根据二硫化碳的结构确定NO2+中π键个数;
(4)利用均摊法确定其化学式;根据ρ=
| m |
| V |
(5)能和硝酸银反应生成白色沉淀的是配合物中外界氯离子,根据硝酸银的物质的量计算配合物化学式中氯离子个数,再根据配位数确定內界,从而确定其化学式.
解答:
解:(1)铬是24号元素,其原子核外有24个电子,根据工作原理知其基态核外电子排布式为:1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(3)分子晶体的熔沸点较低,氯化铬酰的熔沸点较低,所以属于分子晶体;二硫化碳和NO2+的结构相似,根据二硫化碳的结构知NO2+中有2个π键,所以1mol NO2+中含有π键数目为2NA,故答案为:分子;2NA;
(4)该晶胞中氮原子个数=8×
+6×
=4,Cr原子个数=1+12×
=4,所以其化学式为:CrN;N与Cr核间距离为apm,则晶胞边长为2apm=2a×10-10cm,晶胞体积为8a3×10-30cm,晶胞中含有4个微粒,则晶胞质量为:
g,密度为:
,
故答案为:
;
(5)能和硝酸银反应生成白色沉淀的是配合物中外界氯离子,n(AgNO3)=2mol?L-1×0.05L=0.1mol,0.1molCrCl3?6H2O和0.1mol硝酸银反应生成氯化银沉淀,所以该配合物外界氯离子个数是1,则有2个氯原子是配位原子,该配合物的配位数是6,所以有4个水分子是配体,则该配离子的化学式为[Cr(H2O)4Cl2]+,
故答案为:[Cr(H2O)4Cl2]+.
(3)分子晶体的熔沸点较低,氯化铬酰的熔沸点较低,所以属于分子晶体;二硫化碳和NO2+的结构相似,根据二硫化碳的结构知NO2+中有2个π键,所以1mol NO2+中含有π键数目为2NA,故答案为:分子;2NA;
(4)该晶胞中氮原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 4×(52+14) |
| 6.02×1023 |
| 4×(52+14) |
| 6.02×1023×8a3×10-30 |
故答案为:
| 4×(52+14) |
| 6.02×1023×8a3×10-30 |
(5)能和硝酸银反应生成白色沉淀的是配合物中外界氯离子,n(AgNO3)=2mol?L-1×0.05L=0.1mol,0.1molCrCl3?6H2O和0.1mol硝酸银反应生成氯化银沉淀,所以该配合物外界氯离子个数是1,则有2个氯原子是配位原子,该配合物的配位数是6,所以有4个水分子是配体,则该配离子的化学式为[Cr(H2O)4Cl2]+,
故答案为:[Cr(H2O)4Cl2]+.
点评:本题考查物质结构和性质,这些知识点都是学习重点、高考热点,难点是确定配离子化学式,难度中等,其中涉及到晶体计算,应注意晶体中所含微粒数目.

练习册系列答案
相关题目
某气态烃10mL与50mL氧气在一定条件下作用,刚好耗尽反应物,生成水蒸气40mL、一氧化碳和二氧化碳各20mL(各体积都是在同温同压下测得).该气态烃为( )
| A、C3H8 |
| B、C4H6 |
| C、C3H6 |
| D、C4H8 |
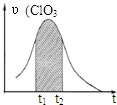 KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图.下列说法正确的( )
KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图.下列说法正确的( )| A、反应开始时速率增大可能是c(H+)所致 |
| B、纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合 |
| C、后期速率υ下降的主要原因是反应向逆反应方向进行 |
| D、图中阴影“面积”可以表示t1-t2时间内c(Cl-)增加量 |