题目内容
把一块表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片23.9g投入100mL 9mol/L的硝酸中,充分反应后,固体全部溶解,硝酸只被还原成NO2和NO(假设生成气体全部逸出),反应后溶液中H+为0.16mol.往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体.
(1)写出铜绿和硝酸反应的离子方程式 .
(2)过滤沉淀过程中用到的玻璃仪器除了烧杯外还有 、 .
(3)已知2NO2+2NaOH═NaNO3+NaNO2+H2O,NO+NO2+2NaOH═2NaNO2+H2O.现将反应后生成的气体用过量NaOH溶液吸收,为使氮氧化物充分吸收,还需通入一定量氧气.
①最少应通入氧气的体积(标准状况)为 升.
②参加反应的NaOH的物质的量为 摩尔.
(1)写出铜绿和硝酸反应的离子方程式
(2)过滤沉淀过程中用到的玻璃仪器除了烧杯外还有
(3)已知2NO2+2NaOH═NaNO3+NaNO2+H2O,NO+NO2+2NaOH═2NaNO2+H2O.现将反应后生成的气体用过量NaOH溶液吸收,为使氮氧化物充分吸收,还需通入一定量氧气.
①最少应通入氧气的体积(标准状况)为
②参加反应的NaOH的物质的量为
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:(1)铜绿和硝酸反应生成硝酸铜、二氧化碳与水;
(2)过滤沉淀过程中用到的玻璃仪器有:烧杯、玻璃棒、漏斗;
(3)干燥后得到29.4g蓝色固体为Cu(OH)2,n[Cu(OH)2]=
=0.3mol,设NO2和NO的物质的量分别为xmol、ymol,根据氮元素守恒可知,二者物质的量之和等于原硝酸溶液中硝酸的物质的量减去反应后溶液中硝酸根的物质的量,再根据电子转移守恒列方程计算:
①当NO:NO2=1:1时需要氧气最少,计算通入氧气后NO、NO2的物质的量,根据反应的NO计算最少应通入n(O2),再根据V=nVm计算;
②由化学式NaNO3、NaNO2可知,氮原子与钠原子物质的量之比为1:1,故n(NaOH)=n(N),放出的气体中含有二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠,由钠离子守恒可知n(NaOH)=2n(Na2CO3),根据碳原子守恒计算n(Na2CO3),上述两部分氢氧化钠之和为消耗的氢氧化钠,据此解答.
(2)过滤沉淀过程中用到的玻璃仪器有:烧杯、玻璃棒、漏斗;
(3)干燥后得到29.4g蓝色固体为Cu(OH)2,n[Cu(OH)2]=
| 29.4g |
| 98g/mol |
①当NO:NO2=1:1时需要氧气最少,计算通入氧气后NO、NO2的物质的量,根据反应的NO计算最少应通入n(O2),再根据V=nVm计算;
②由化学式NaNO3、NaNO2可知,氮原子与钠原子物质的量之比为1:1,故n(NaOH)=n(N),放出的气体中含有二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠,由钠离子守恒可知n(NaOH)=2n(Na2CO3),根据碳原子守恒计算n(Na2CO3),上述两部分氢氧化钠之和为消耗的氢氧化钠,据此解答.
解答:
解:(1)铜绿和硝酸反应生成硝酸铜、二氧化碳与水,反应离子方程式为:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑,
故答案为:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑;
(2)过滤沉淀过程中用到的玻璃仪器有:烧杯、玻璃棒、漏斗,
故答案为:玻璃棒;漏斗;
(3)干燥后得到29.4g蓝色固体为Cu(OH)2,n[Cu(OH)2]=
=0.3mol,根据铜元素守恒n(Cu)=n[Cu(OH)2]=0.3mol,
由题意可知,反应后硝酸有剩余,溶液中溶质为硝酸铜、硝酸,根据硝酸根守恒可知,溶液中n(NO3-)=n(HNO3)+2n[Cu(NO3)2]=0.16mol+2×0.3mol=0.76mol,
设NO2和NO的物质的量分别为xmol、ymol,根据氮元素守恒可知,二者物质的量之和等于原硝酸溶液中硝酸的物质的量减去反应后溶液中硝酸根的物质的量,则:x+y=0.1×9-0.76,
再根据电子转移守恒有:x+3y=0.2×2,
联立方程,解得x=0.01,y=0.13,
①当NO:NO2=1:1时需要氧气最少,则加入氧气后NO的物质的量=
×(0.01mol+0.13mol)=0.07mol,故与氧气反应转化为二氧化氮的NO的物质的量为:0.13mol-0.07mol=0.06mol,2NO+O2=2NO2可知,需要氧气最少为
×0.06mol=0.03mol,体积为0.03mol×22.4L/mol=0.672L,
故答案为:0.672L;
②由化学式NaNO3、NaNO2可知,氮原子与钠原子物质的量之比为1:1,故n(NaOH)=n(N)=0.01mol+0.13mol=0.14mol,
放出的气体中含有二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠,根据碳原子守恒计算n(Na2CO3)=n[Cu2(OH)2CO3]=0.05mol,由钠离子守恒可知n(NaOH)=2n(Na2CO3)=0.1mol,
故消耗的氢氧化钠的物质的量=0.14mol+0.1mol=0.24mol,
故答案为:0.24.
故答案为:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑;
(2)过滤沉淀过程中用到的玻璃仪器有:烧杯、玻璃棒、漏斗,
故答案为:玻璃棒;漏斗;
(3)干燥后得到29.4g蓝色固体为Cu(OH)2,n[Cu(OH)2]=
| 29.4g |
| 98g/mol |
由题意可知,反应后硝酸有剩余,溶液中溶质为硝酸铜、硝酸,根据硝酸根守恒可知,溶液中n(NO3-)=n(HNO3)+2n[Cu(NO3)2]=0.16mol+2×0.3mol=0.76mol,
设NO2和NO的物质的量分别为xmol、ymol,根据氮元素守恒可知,二者物质的量之和等于原硝酸溶液中硝酸的物质的量减去反应后溶液中硝酸根的物质的量,则:x+y=0.1×9-0.76,
再根据电子转移守恒有:x+3y=0.2×2,
联立方程,解得x=0.01,y=0.13,
①当NO:NO2=1:1时需要氧气最少,则加入氧气后NO的物质的量=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:0.672L;
②由化学式NaNO3、NaNO2可知,氮原子与钠原子物质的量之比为1:1,故n(NaOH)=n(N)=0.01mol+0.13mol=0.14mol,
放出的气体中含有二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠,根据碳原子守恒计算n(Na2CO3)=n[Cu2(OH)2CO3]=0.05mol,由钠离子守恒可知n(NaOH)=2n(Na2CO3)=0.1mol,
故消耗的氢氧化钠的物质的量=0.14mol+0.1mol=0.24mol,
故答案为:0.24.
点评:本题考查混合物的有关计算,难度较大,注意根据守恒进行的计算,(3)中①关键是判断通入氧气后NO:NO2=1:1时需要氧气最少,②为易错点,学生容易忽略气体中二氧化碳与氢氧化钠反应.

练习册系列答案
相关题目
 铬及其化合物在工业上用重要用途,请回答下列问题:
铬及其化合物在工业上用重要用途,请回答下列问题:
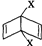 和
和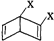 之外,还有多种同分异构体,
之外,还有多种同分异构体,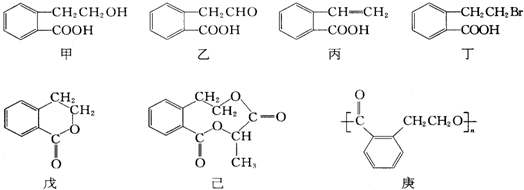
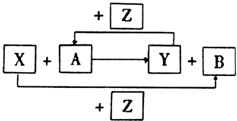 X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)
X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)