题目内容
如图一是煤化工产业链的一部分,试运用所学知识,回答下列问题:
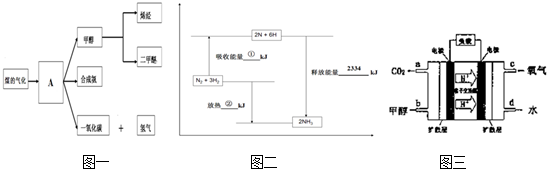
(1)如图一中气体A的俗称是 .
(2)合成氨工业是煤化工产业链中非常重要的一步.已知有一组数据:破坏1mol氮气中的化学键需要吸收946kJ能量;破坏0.5mol氢气中的H-H键需要吸收218kJ的能量;形成氨分子中1mol N-H键能够释放389kJ能量.如图二表示合成氨工业过程中能量的变化,请将图②中的能量变化的数值为 kJ.
(3)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如图三所示,该燃料电池的电池反应式为2CH3OH (g)+3O2(g)═2CO2(g)+4H2O(l),则负极的电极反应式为 ,正极附近pH值 (填写“增大”、“减小”或者“不变”).

(1)如图一中气体A的俗称是
(2)合成氨工业是煤化工产业链中非常重要的一步.已知有一组数据:破坏1mol氮气中的化学键需要吸收946kJ能量;破坏0.5mol氢气中的H-H键需要吸收218kJ的能量;形成氨分子中1mol N-H键能够释放389kJ能量.如图二表示合成氨工业过程中能量的变化,请将图②中的能量变化的数值为
(3)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如图三所示,该燃料电池的电池反应式为2CH3OH (g)+3O2(g)═2CO2(g)+4H2O(l),则负极的电极反应式为
考点:煤的干馏和综合利用,有关反应热的计算,化学电源新型电池
专题:电化学专题,有机化学基础
分析:(1)煤的气化生成CO和氢气;
(2)根据能量守恒计算,等于形成生成物中新的化学键释放的能量减去破坏1mol氮气和3mol氢气中化学键所吸收的能量;
(3)根据氢离子的移动方向知,右边电极是正极,左边电极是负极,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,据此书写电极反应式,然后根据电极反应式判断正极附近的pH值.
(2)根据能量守恒计算,等于形成生成物中新的化学键释放的能量减去破坏1mol氮气和3mol氢气中化学键所吸收的能量;
(3)根据氢离子的移动方向知,右边电极是正极,左边电极是负极,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,据此书写电极反应式,然后根据电极反应式判断正极附近的pH值.
解答:
解:(1)煤的气化生成CO和氢气,俗称水煤气,故答案为:水煤气;
(2))①为破坏1mol氮气和3mol氢气中化学键所吸收的能量,等于946kJ+3×2×218kJ=2254kJ,
②中的能量变化等于形成生成物中新的化学键释放的能量减去破坏1mol氮气和3mol氢气中化学键所吸收的能量,即:2334kJ-2254kJ=80kJ,
故答案为:80;
(3)可燃物甲醇在负极失去电子生成二氧化碳,负极电极反应式为:CH3OH-6e-+H2O=CO2+6H+,正极为氧气得电子生成氢氧根离子,所以正极附近的PH值增大,
故答案为:CH3OH-6e-+H2O=CO2+6H+;增大.
(2))①为破坏1mol氮气和3mol氢气中化学键所吸收的能量,等于946kJ+3×2×218kJ=2254kJ,
②中的能量变化等于形成生成物中新的化学键释放的能量减去破坏1mol氮气和3mol氢气中化学键所吸收的能量,即:2334kJ-2254kJ=80kJ,
故答案为:80;
(3)可燃物甲醇在负极失去电子生成二氧化碳,负极电极反应式为:CH3OH-6e-+H2O=CO2+6H+,正极为氧气得电子生成氢氧根离子,所以正极附近的PH值增大,
故答案为:CH3OH-6e-+H2O=CO2+6H+;增大.
点评:本题考查知识点全面,综合性较强,涉及反应热和焓变的计算、化学平衡状态的判定、燃料电池等知识,明确燃料电池中正负极上得失电子是解答(4)的关键,题目难度较大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是( )
| A、食盐 | B、食醋 | C、烧碱 | D、纯碱 |
下列溶液中物质的量浓度为1mol/L的是( )
| A、将40 g NaOH溶解于1 L水中 |
| B、将22.4 L HCl气体溶解于水配成1 L溶液 |
| C、将1 L 5 mol/L的盐酸加水稀释至5L |
| D、将10 g NaOH配制成 250 mL溶液 |
 铬及其化合物在工业上用重要用途,请回答下列问题:
铬及其化合物在工业上用重要用途,请回答下列问题: 如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.
如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.