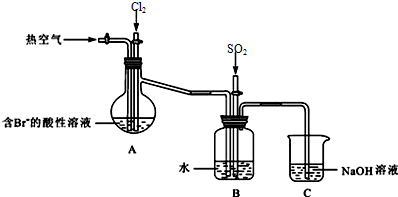
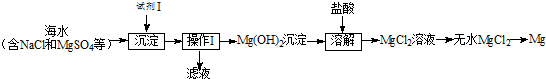题目内容
氨在国民经济中占有重要的地位,请参与下列探究.
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.
C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ/mol,△S=+133.7J/(mol?K)
该反应在低温下能否自发反应 (填“能”或“否”).
(2)已知在400℃时,N2(g)+3H2(g)?2NH3(g)的K′=0.5.
①2NH3(g)?N2(g)+3H2(g)的K= (填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正 v(N2)逆(填“>”、“<”、“=”或“不确定”).
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.
C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ/mol,△S=+133.7J/(mol?K)
该反应在低温下能否自发反应
(2)已知在400℃时,N2(g)+3H2(g)?2NH3(g)的K′=0.5.
①2NH3(g)?N2(g)+3H2(g)的K=
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正
考点:焓变和熵变,化学平衡常数的含义
专题:化学反应中的能量变化,化学平衡专题
分析:(1)判断△H-T△S是否小于0;
(2)①相同温度下,同一可逆反应的正逆平衡常数互为倒数关系;
②根据浓度熵和平衡常数之间的关系来判断反应的状态;
(2)①相同温度下,同一可逆反应的正逆平衡常数互为倒数关系;
②根据浓度熵和平衡常数之间的关系来判断反应的状态;
解答:
解:(1)△H-T△S=131.3kJ/mol-T×0.1337KJ/(mol?K),低温时,131.3kJ/mol-T×0.1337KJ/(mol?K)>0,反应不能自发进行;
故:否;
(2)①相同温度下,同一可逆反应的正逆平衡常数互为倒数关系,在400℃时,N2(g)+3H2(g)?2NH3(g)的K′=0.5,则2NH3(g)?N2(g)+3H2(g)的K=
=2;
故答案为:2;
②一段时间后,当N2、H2、NH3的物质的量分别为4mol/L、2mol/L、4mol/L时,Qc
=0.5,QC=K所以该状态是平衡状态,正逆反应速率相等;
故答案为:=.
故:否;
(2)①相同温度下,同一可逆反应的正逆平衡常数互为倒数关系,在400℃时,N2(g)+3H2(g)?2NH3(g)的K′=0.5,则2NH3(g)?N2(g)+3H2(g)的K=
| 1 |
| K′ |
故答案为:2;
②一段时间后,当N2、H2、NH3的物质的量分别为4mol/L、2mol/L、4mol/L时,Qc
| C2(NH3) |
| C(N2)C3(H2) |
故答案为:=.
点评:本题考查反应自发进行的方向、化学平衡移动的问题,题目难度中等,注意把握平衡常数的意义及应用是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
胃酸的主要成分是盐酸,胃酸过多的病人需用药物治疗,下列药物(主要成分)不能用于治疗胃酸过多是( )
| A、NaCl |
| B、Al(OH)3 |
| C、CaCO3 |
| D、Mg(OH)2 |
有关晶体与晶胞的叙述正确的是( )
| A、晶胞是晶体结构中的基本结构单元 |
| B、晶体的外观规则,但是有些内部结构是无序的 |
| C、晶体是晶胞的堆积 |
| D、晶胞都是正八面体 |


 铬及其化合物在工业上用重要用途,请回答下列问题:
铬及其化合物在工业上用重要用途,请回答下列问题: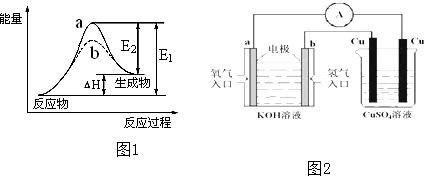
 如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.
如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.