题目内容
NH3经一系列反应可以得到HNO3和NH4NO3,如图所示.

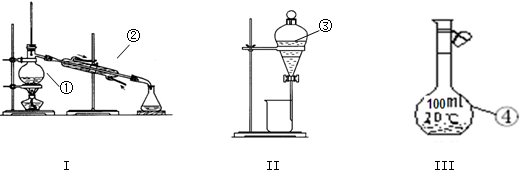
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是 .
(2)Ⅱ中,2NO(g)+O2(g)?2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图1).
①p1、p2的大小关系 .
②随温度升高,该反应平衡常数变化的趋势是 .
(3)IV中,电解NO制备NH4NO3,其工作原理如图2所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是 .


(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是
(2)Ⅱ中,2NO(g)+O2(g)?2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图1).
①p1、p2的大小关系
②随温度升高,该反应平衡常数变化的趋势是
(3)IV中,电解NO制备NH4NO3,其工作原理如图2所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是

考点:氨的化学性质,化学平衡的影响因素,转化率随温度、压强的变化曲线
专题:基本概念与基本理论,氮族元素
分析:(1)在催化剂、加热条件下,氨气被氧化生成NO和水;
(2)①相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大;
②根据图象知,相同压强下,升高温度,NO转化率减小,说明正反应是放热反应,据此判断化学平衡常数与温度的关系;
(3)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,根据转移电子守恒判断需要加入物质.
(2)①相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大;
②根据图象知,相同压强下,升高温度,NO转化率减小,说明正反应是放热反应,据此判断化学平衡常数与温度的关系;
(3)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,根据转移电子守恒判断需要加入物质.
解答:
解:(1)在催化剂、加热条件下,氨气被氧化生成NO和水,反应方程式为4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(2)①相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,根据图象知,相同温度下,p2的转化率大于p1,所以p2>p1,故答案为:p2>p1;
②根据图象知,相同压强下,升高温度,NO转化率减小,说明正反应是放热反应,升高温度平衡向逆反应方向移动,则化学平衡常数减小,故答案为:变小;
(3)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,故答案为:NH3.
| ||
| △ |
| ||
| △ |
(2)①相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,根据图象知,相同温度下,p2的转化率大于p1,所以p2>p1,故答案为:p2>p1;
②根据图象知,相同压强下,升高温度,NO转化率减小,说明正反应是放热反应,升高温度平衡向逆反应方向移动,则化学平衡常数减小,故答案为:变小;
(3)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O
| ||
点评:本题以氨气为载体考查了氧化还原反应、电解原理、化学平衡等知识点,综合性较强,采用“定一议二”的方法分析(2)题,正确书写电极反应式是解(3)题关键,难度中等.

练习册系列答案
相关题目
“盐荒”谣言:加碘食盐能预防放射性碘辐射.碘盐中常添加碘酸钾(KIO3),下列性质可以证明碘酸钾所属晶体类型的是( )
| A、具有较高的熔点 |
| B、熔融状态能导电 |
| C、水溶液能导电 |
| D、常温下能溶于水 |
下列实验操作能达到预期实验目的是( )
| A、为检验卤代烃中的卤原子,先加入NaOH溶液加热,再滴入AgNO3溶液观察颜色变化 |
| B、为检验醛基的存在,先向试管中加入2mL 2%的NaOH溶液和数滴CuSO4溶液,再加乙醛,煮沸 |
| C、为制取乙酸乙酯,将稀H2SO4和乙醇、乙酸混合加热,放出的蒸气通入盛有Na2CO3溶液的试管中 |
| D、为制取乙烯,将稀H2SO4和乙醇混合加热 |
有关晶体与晶胞的叙述正确的是( )
| A、晶胞是晶体结构中的基本结构单元 |
| B、晶体的外观规则,但是有些内部结构是无序的 |
| C、晶体是晶胞的堆积 |
| D、晶胞都是正八面体 |
下列溶液中物质的量浓度为1mol/L的是( )
| A、将40 g NaOH溶解于1 L水中 |
| B、将22.4 L HCl气体溶解于水配成1 L溶液 |
| C、将1 L 5 mol/L的盐酸加水稀释至5L |
| D、将10 g NaOH配制成 250 mL溶液 |


 铬及其化合物在工业上用重要用途,请回答下列问题:
铬及其化合物在工业上用重要用途,请回答下列问题: 如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.
如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.
 和
和 之外,还有多种同分异构体,
之外,还有多种同分异构体,